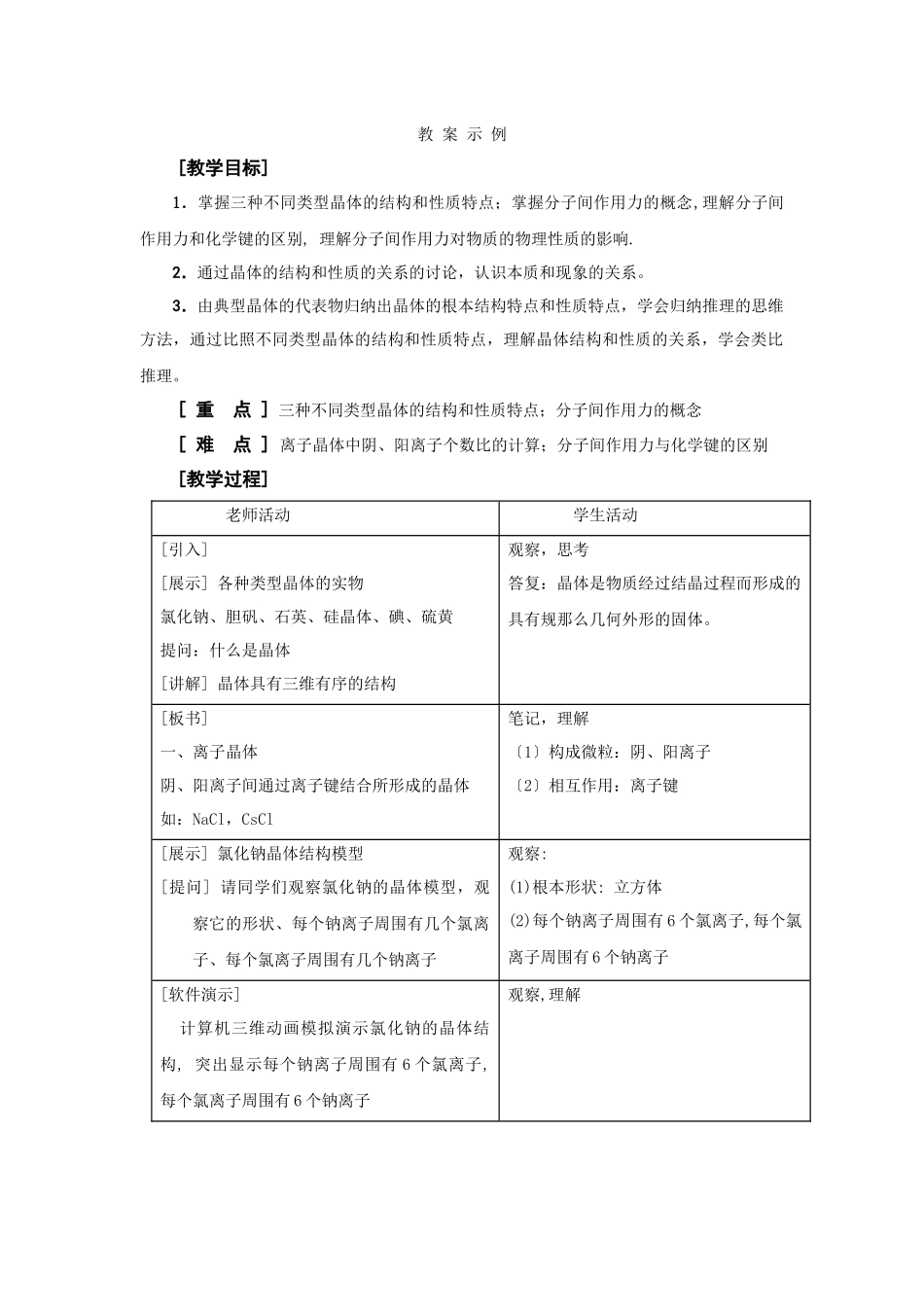
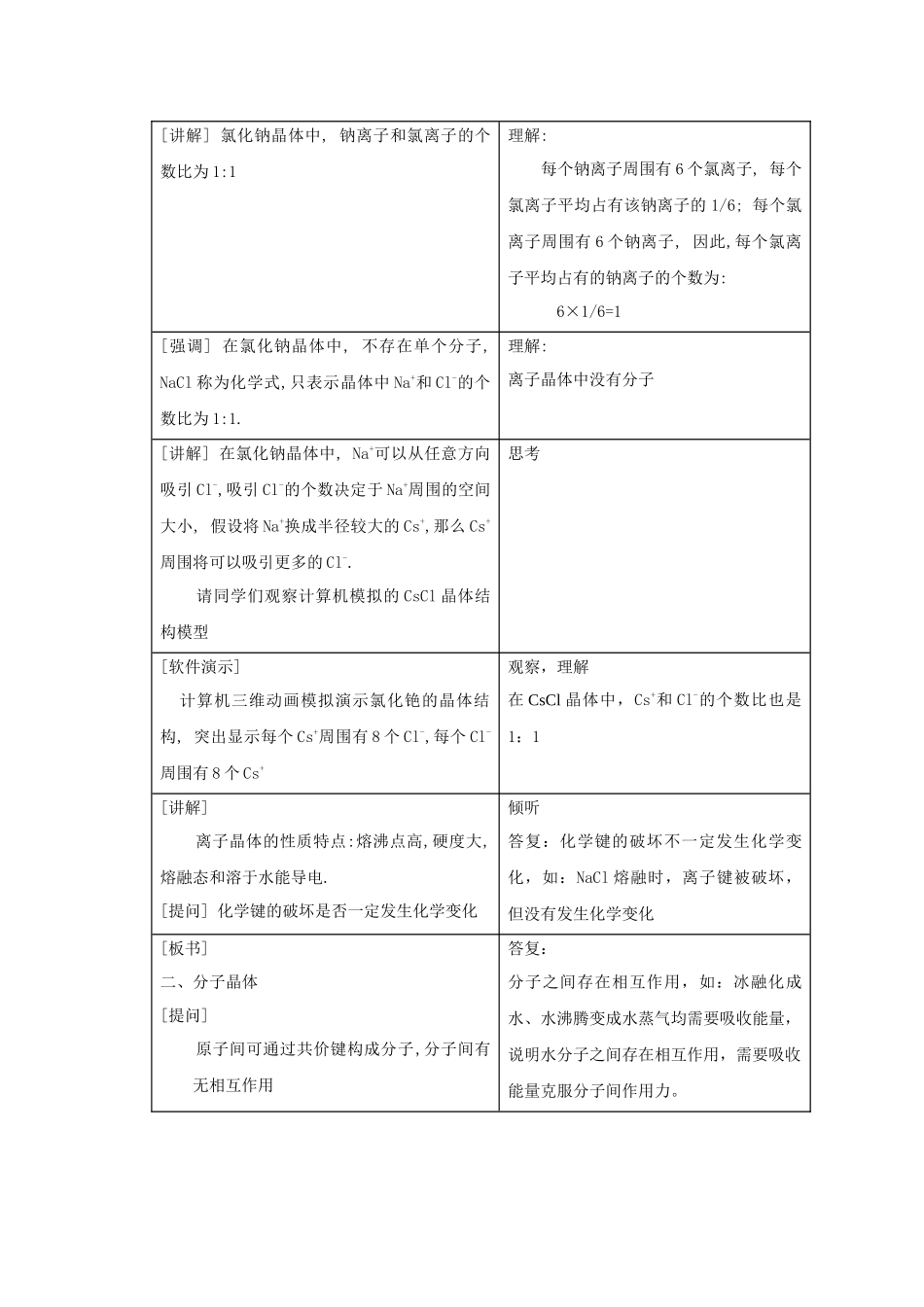
教 案 示 例[教学目标] 1.掌握三种不同类型晶体的结构和性质特点;掌握分子间作用力的概念,理解分子间作用力和化学键的区别, 理解分子间作用力对物质的物理性质的影响.2.通过晶体的结构和性质的关系的讨论,认识本质和现象的关系。3.由典型晶体的代表物归纳出晶体的根本结构特点和性质特点,学会归纳推理的思维方法,通过比照不同类型晶体的结构和性质特点,理解晶体结构和性质的关系,学会类比推理。[ 重 点 ] 三种不同类型晶体的结构和性质特点;分子间作用力的概念[ 难 点 ] 离子晶体中阴、阳离子个数比的计算;分子间作用力与化学键的区别[教学过程] 老师活动 学生活动 [引入] [展示] 各种类型晶体的实物氯化钠、胆矾、石英、硅晶体、碘、硫黄提问:什么是晶体[讲解] 晶体具有三维有序的结构观察,思考答复:晶体是物质经过结晶过程而形成的具有规那么几何外形的固体。[板书]一、离子晶体阴、阳离子间通过离子键结合所形成的晶体如:NaCl,CsCl笔记,理解〔1〕构成微粒:阴、阳离子〔2〕相互作用:离子键[展示] 氯化钠晶体结构模型[提问] 请同学们观察氯化钠的晶体模型,观察它的形状、每个钠离子周围有几个氯离子、每个氯离子周围有几个钠离子 观察:(1)根本形状: 立方体(2)每个钠离子周围有 6 个氯离子,每个氯离子周围有 6 个钠离子[软件演示] 计算机三维动画模拟演示氯化钠的晶体结构, 突出显示每个钠离子周围有 6 个氯离子,每个氯离子周围有 6 个钠离子观察,理解[讲解] 氯化钠晶体中, 钠离子和氯离子的个数比为 1:1理解: 每个钠离子周围有 6 个氯离子, 每个氯离子平均占有该钠离子的 1/6; 每个氯离子周围有 6 个钠离子, 因此,每个氯离子平均占有的钠离子的个数为: 6×1/6=1[强调] 在氯化钠晶体中, 不存在单个分子, NaCl 称为化学式,只表示晶体中 Na+和 Cl-的个数比为 1:1.理解:离子晶体中没有分子[讲解] 在氯化钠晶体中, Na+可以从任意方向吸引 Cl-,吸引 Cl-的个数决定于 Na+周围的空间大小, 假设将 Na+换成半径较大的 Cs+,那么 Cs+周围将可以吸引更多的 Cl-. 请同学们观察计算机模拟的 CsCl 晶体结构模型思考[软件演示] 计算机三维动画模拟演示氯化铯的晶体结构, 突出显示每个 Cs+周围有 8 个 Cl-,每个 Cl-周围有 8 个 Cs+观察,理解在 CsCl 晶体中,Cs+和 Cl-的个数比也是1:1[讲解] 离子晶体的性质特点:熔沸点高,硬度大,熔融态和溶于水能导电.[提问...