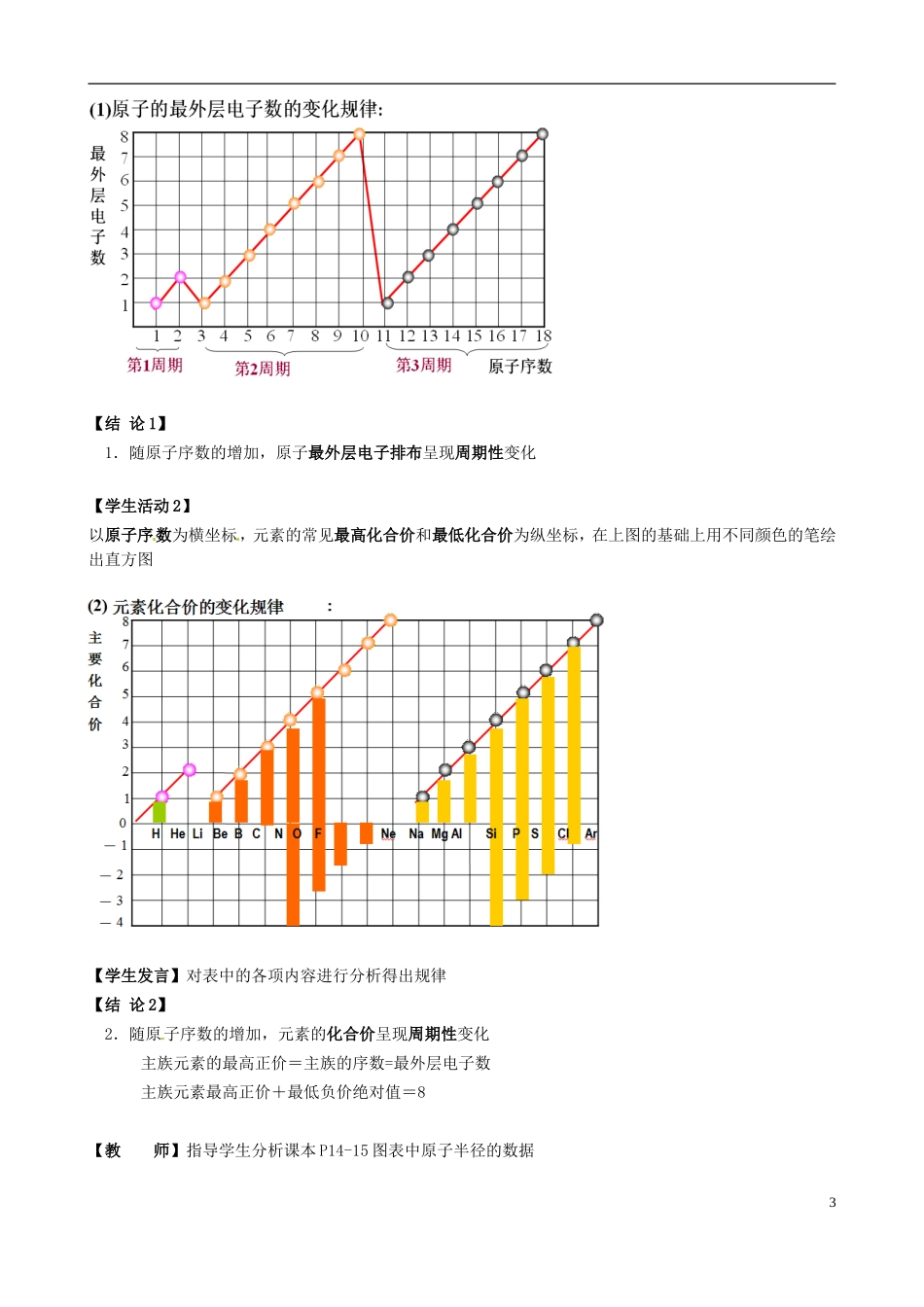
广东省第二师范学院番禺附属中学 2014 高中化学 1.2 元素周期律(第一课时)教学案 新人教版必修 2一、学情分析掌握元素周期律,学生可对物质的性质进行归类、类比、推测,避免学生对元素化合物知识死记硬背。对学生而言,元素周期律是一把开启化学思维大门的金钥匙,它能指导学生有规律的、轻松的掌握元素化合物性质,并能进一步探究元素化合物的性质。学生已经学习钠、铝、硅、氯、硫、氮等元素化合物的知识,为元素周期律的学习提供了充分的感性资料;第一节也学习了原子结构和周期表的结构,二、教学目标知识与技能1.了解原子核外电子排布(电子层、最外层电子数)的一般规律。2.了解化合价、原子半径的周期性变化规律。过程与方法1.利用教材的科学探究 1 栏目,用图表来表示原子序数与原子的最外层电子数,元素的原子半径,元素的常见最高正化合价和最低负化合价的关系,指导学生归纳得出元素周期律。2.利用教材的 P13 的图表和 P14 科学探究原子半径的栏目,培养学生分析问题、培养整合知识的能力以及逻辑推断能力。情感态度与价值观1.在作图分析数据的同时,培养学生耐心、细致的科学素养。2.实验探究过程中,培养学生务实的实验态度,激发勇于探究的科学精神。 重难点:重点:原子核外电子排布(电子层、最外层电子数)、化合价、原子半径的一般规律难点:原子核外电子排布的规律,书写 1-20 号元素的原子结构示意图三、教学策略1.利用作图、图表的方式突破重点教学教材已经提供了大量具体的素材帮助学生归纳元素周期律的内涵,但大部分的学生对于课本的素材仍然缺乏感性的分析,很难把握素材所体现的规律。为此,对于同周期元素核外电子层数的变化、原子半径的变化、化合价的变化,可利用图表展示的方法,直观的让学生感受什么叫“周期”的变化。四、教学思路1五、教学过程小测:默写 1-20 号元素符号(一)原子核外电子排布一般规律【引 入】找几位同学演示电子的分层运动;根据图片引入课题【归 纳】1.核外电子围绕原子核分层排布;2.离核越近区域内电子能量越低,电子尽先从内层排起;3.第一层最多排 2 个电子,最外层最多排 8 个电子,记住 1-20 号元素核外电子排布。【过 渡】教材第 14 页科学探究 1:让学生写出 1~18 号元素的元素符号和原子结构示意图(填到课本 P14、15 页表格)(二)元素周期律【学生活动 1】(从以上原子结构示意图中,大家能找到 1~18 号元素原子核外电子排布...