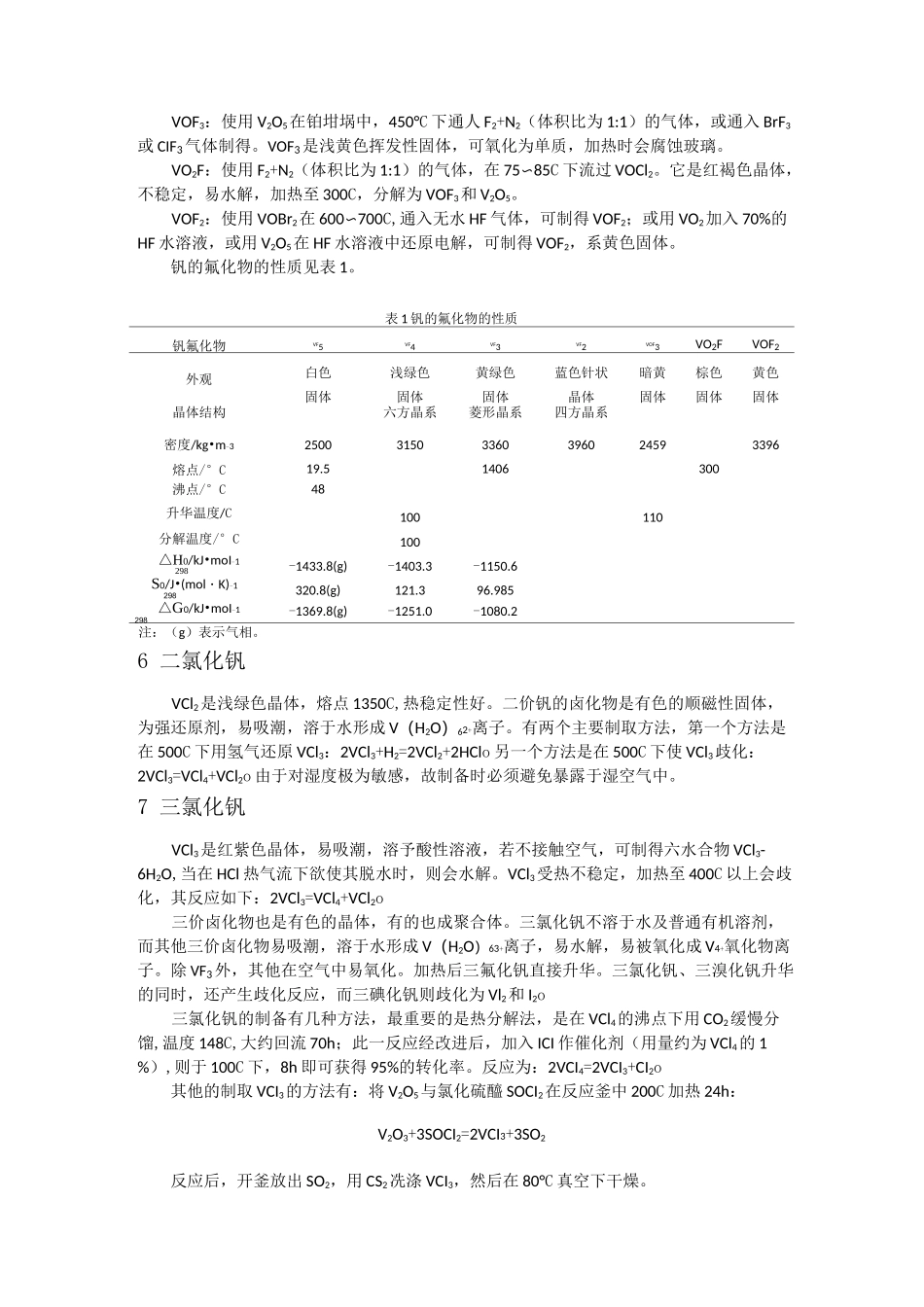
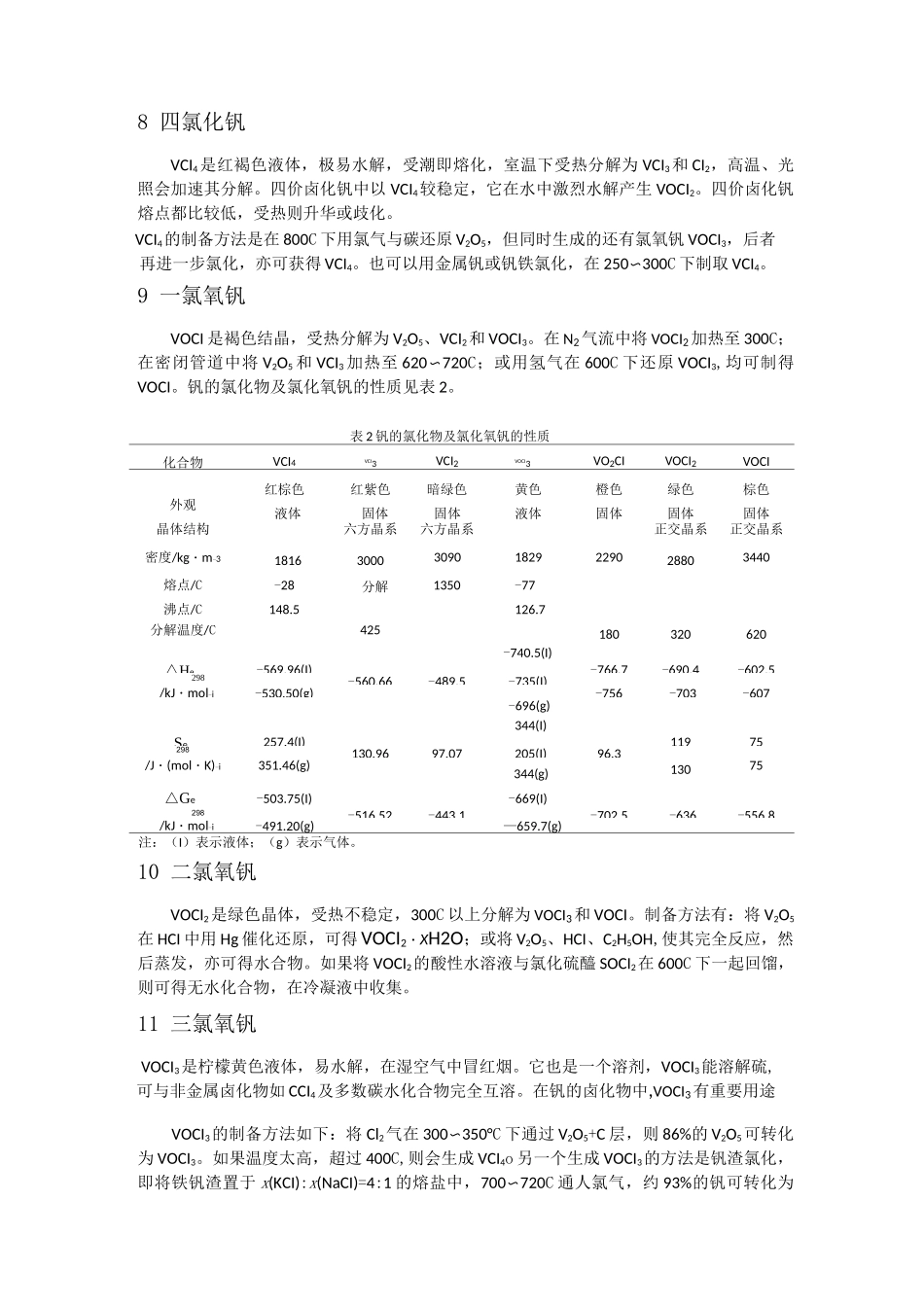
钒的卤素化合物的性质及其化学反应1 二氟化钒使用 VF3+H2+HF(不含水)在 1150r 下控制还原程度,可制得 VF2。也可用 V2O5在氮气氛下,在 HF 水溶液中电解还原制得 VF3・4H2O,将它加热到 120°C,可脱水得 VF3・2 巧 0,继续加热至 200C,也得不到无水化合物。2 三氟化钒将 VCl3或 VBr3置于铂坩埚中,加热至 600C,通入含 HF 的无水%气,即可得 VF3。VF4在 100〜120C 进行歧化反应,也可得 VF3。另外将金属钒直接在 200C 通 F2气氛化,亦可得 VF3 及其他氟化物。由于 VF3 是不挥发物,故新生成的 VF3 会包裹在原料的表面,阻碍反应继续进行,故最好的方法是采用六氟钒酸铵热分解,首先在铂坩埚中,在 210〜250C 下通纯氩气 2h,按下式制取六氟钒酸铵:V2O3+6NH4HF2=2(NH4)3VF6+3H2Oo 得到的六氟钒酸铵再于 600〜700C 下,在纯氩气氛下分解:2(NH4)3VF6=VF3+3NH4Fo 此外 VF3也可以将 V2O5在 HF 水溶液中电解还原制得。VF3不溶于水,是黄绿色固体,在 1406C 熔化而不分解。3 四氟化钒VF4的制备方法很多。最初是利用 VCI4与 HF 在一 28C 下反应制得,这个反应如果令其在一个例如 CClF3的惰性溶液中,在一 78C 下进行,则效果更佳,制得的 VF4产品更纯。也可以在 150C 下用 F2气(在 Ar 气氛下)加热 VCI3制得 VF4。纯 VF4是浅绿色固体,VF4若暴露于湿环境下,则会水解变成红褐色粉,最后形成蓝色糊。VF4为热不稳定性,VF4室温下会缓慢分解为 VF3和 VF5,真空下在 150C 以上会加快分解。4 五氟化钒五氟化钒化学式为 VF5,不稳定,熔点 19.5C,系强氧化剂与氟化剂,五价钒的卤化物更多的是以卤氧钒存在,更为稳定,如 VOF3、VOCI3和 VOBr3oVF5的制备,是在 20 世纪初用 VF4在氮气氛下,在 600C 下缓慢加热而制得。VF4经歧化反应,产物经分馏,得到 VF3和 VF5O也可用金属钒在 300C 下与 F2气体(用 N2稀释)反应制得。VF5溶于水、乙醇、丙酮、四氯化碳,形成红黄色液,VF5在湿空气中迅速水解,它是强氧化剂、氟化剂,VF5 可被多种还原荆(如 PF3)还原成 VF4,但 SO2则与 VF5 在室温下反应形成 VOF3o5 氧钒氟化物钒可形成若干个氧钒氟化物。五价钒可形成 VOF3、VO2F,四价钒与三价钒则可分别形成VOF2、VOF,制备的方法如下。VOF3:使用 V2O5在铂坩埚中,450°C 下通人 F2+N2(体积比为 1:1)的气体,或通入 BrF3或 CIF3气体制得。VOF3是浅黄色挥发性固...