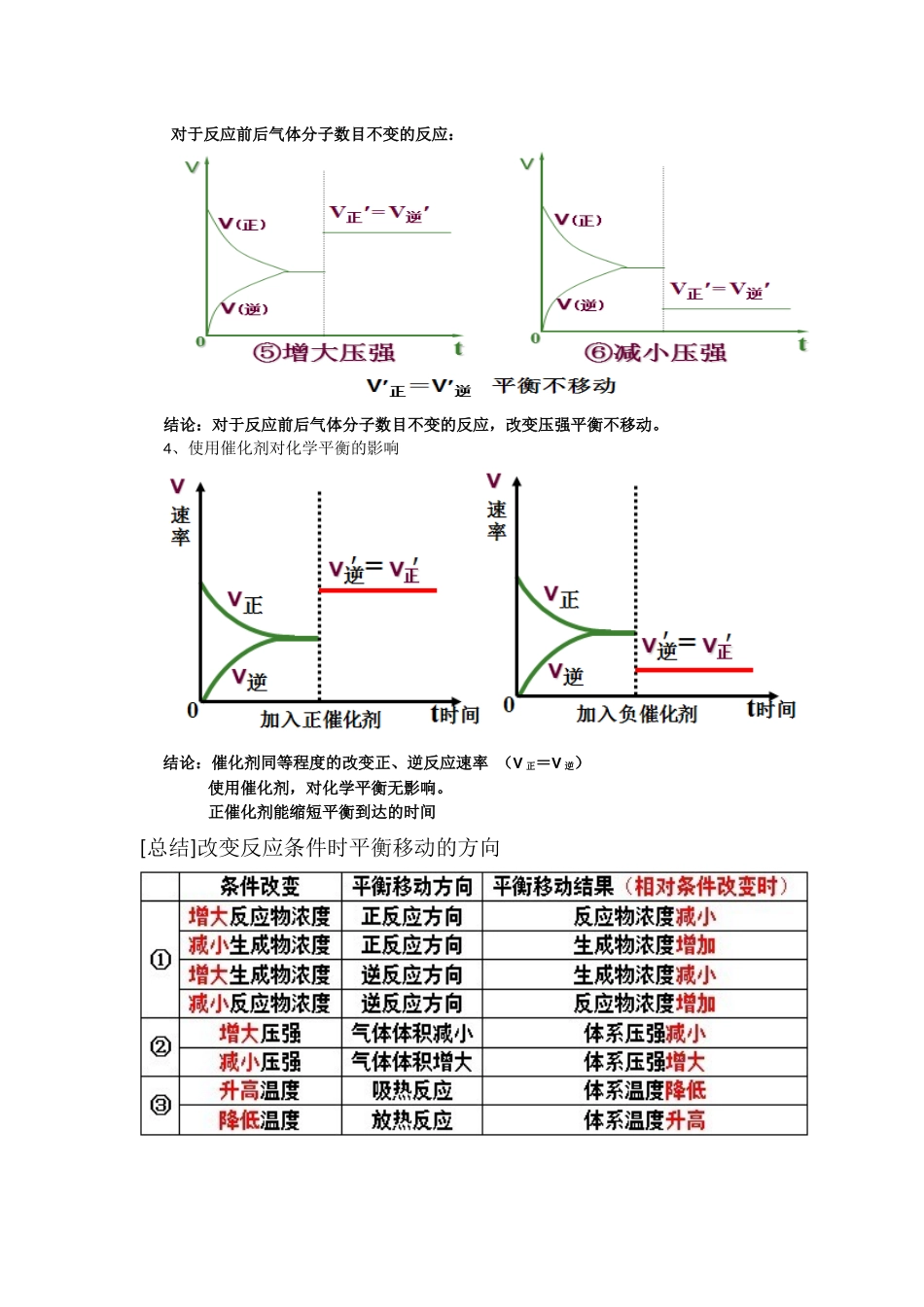
化学平衡移动的图像一、化学平衡的移动二、影响化学平衡移动的条件1、浓度的变化对化学平衡的影响结论:其它条件不变的情况下,①增大反应物浓度或减小生成物浓度平衡向正方向移动②增大生成物浓度或减小反应物浓度平衡向逆方向移动2、温度变化对化学平衡的影响温度的改变对正逆反应速率都会产生影响,但影响的程度不同,温度的变化对吸热反应的速率比放热反应的速率影响大。表现在:升高温度,正、逆反应速率都增大,但增大的倍数不一样,吸热反应增大的倍数大。降低温度,正、逆反应速率都减小,但降低的倍数不一样,吸热反应降低的倍数大。结论:在其他条件不变时,温度升高,会使化学平衡向吸热反应的方向移动,温度降低会使化学平衡向放热的方向移动。注意:温度的变化一定会影响化学平衡,使平衡发生移动3、压强的变化对化学平衡的影响对于反应前后气体分子数有变化的体系:结论:增加压强可使平衡向气体分子数目减小的方向移动;减小压强可使平衡向气体分子数目增大的方向移动.对于反应前后气体分子数目不变的反应:结论:对于反应前后气体分子数目不变的反应,改变压强平衡不移动。4、使用催化剂对化学平衡的影响结论:催化剂同等程度的改变正、逆反应速率(V正=V逆)使用催化剂,对化学平衡无影响。正催化剂能缩短平衡到达的时间[总结]改变反应条件时平衡移动的方向5、化学平衡移动原理——勒夏特列原理早在1888年,法国科学家勒夏特列就发现了这其中的规律,并总结出著名的勒夏特列原理,也叫化学平衡移动原理:勒夏特列原理:如果改变影响平衡的一个条件(如浓度、温度、或压强等),平衡就向能够减弱这种改变的方向移动。注意:①是“减弱”这种改变,不是“消除”这种改变②勒夏特列原理适用于任何动态平衡体系(如:溶解平衡、电离平衡、沉淀平衡、水解平衡等),未平衡状态不能用此来分析③平衡移动原理只能用来判断平衡移动方向,但不能用来判断建立平衡所需时间。