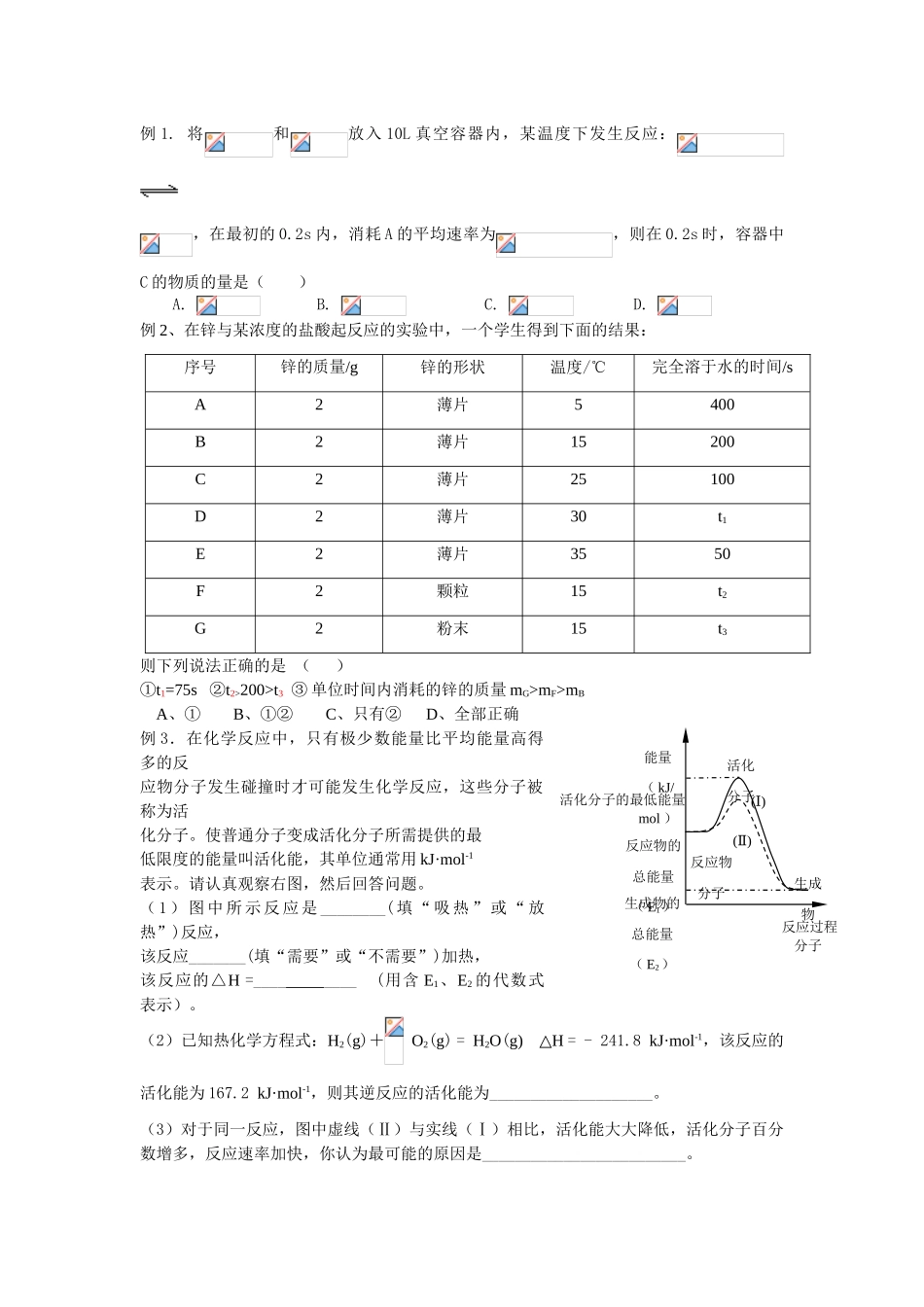
专题八 化学反应速率 灌云县板浦中学 王亚东 【考纲要求】 1.了解化学反应速率的概念、反应速率的定量表示方法。 2.了解活化能对化学反应速率的影响,认识温度、浓度、压强和催化剂影响化学反应速率的一般规律。 3.认识催化剂在生产、生活和科学研究领域中的重大应用。 4.认识化学反应速率的调控在生活、生产和科学研究领域的重要作用。【知识梳理】一、 化学反应速率的有关计算定义 数学表达式 。单位 规律:同一反应用不同物质表示的化学反应速率之间存在如下的关系: 。 计算类型:求速率、起始或平衡浓度、反应时间、容器体积、方程式计量数、物质的量、转化率、速率大小比较等。二、影响化学反应速率的因素(与化学平衡移动不能混淆)内因: 影响反应速率的外因主要有: (一)浓度对化学反应速率的影响: (二)温度对化学反应速率的影响: 。(三)压强对化学反应速率的影响:有气体参与的反应,压强增大,化学反应速率___ 。参加反应的物质是固体,液体或溶液时,压强对反应速率_ _影响?(填有或无)[探讨]N2 + 3H2==2NH3反应在密闭容器中进行1. 容器若为恒定容器,在容器内充入惰性气体,则化学反应速率_____(加快、不变、减慢),原因是_________ 2. 容器若为恒压容器,在容器内充入惰性气体,则反应速率(加快,不变,减慢)_____,原因是________ 。(四)催化剂:(五)其他:[总结] 化学反应速率的微观解释:活化分子活化分子百分数单位体积活化分子数增大浓度增大压强升高温度正催化剂三、 分析化学反应过程中速率变化的原因,或改变反应速率如何选择适当的条件。【典型例题】反应过程能量( kJ/mol )反应物分子生成物分子活化分子反应物的总能量( E1)生成物的总能量( E2)( )Ⅰ( )Ⅱ活化分子的最低能量例 1. 将和放入 10L 真空容器内,某温度下发生反应:,在最初的 0.2s 内,消耗 A 的平均速率为,则在 0.2s 时,容器中C 的物质的量是( ) A. B. C. D. 例 2、在锌与某浓度的盐酸起反应的实验中,一个学生得到下面的结果:序号锌的质量/g锌的形状温度/℃完全溶于水的时间/sA2薄片5400B2薄片15200C2薄片25100D2薄片30t1E2薄片3550F2颗粒15t2G2粉末15t3则下列说法正确的是 ( )①t1=75s ②t2>200>t3 ③ 单位时间内消耗的锌的质量 mG>mF>mBA、① B、①② C、只有② D、全部正确例 3.在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些...