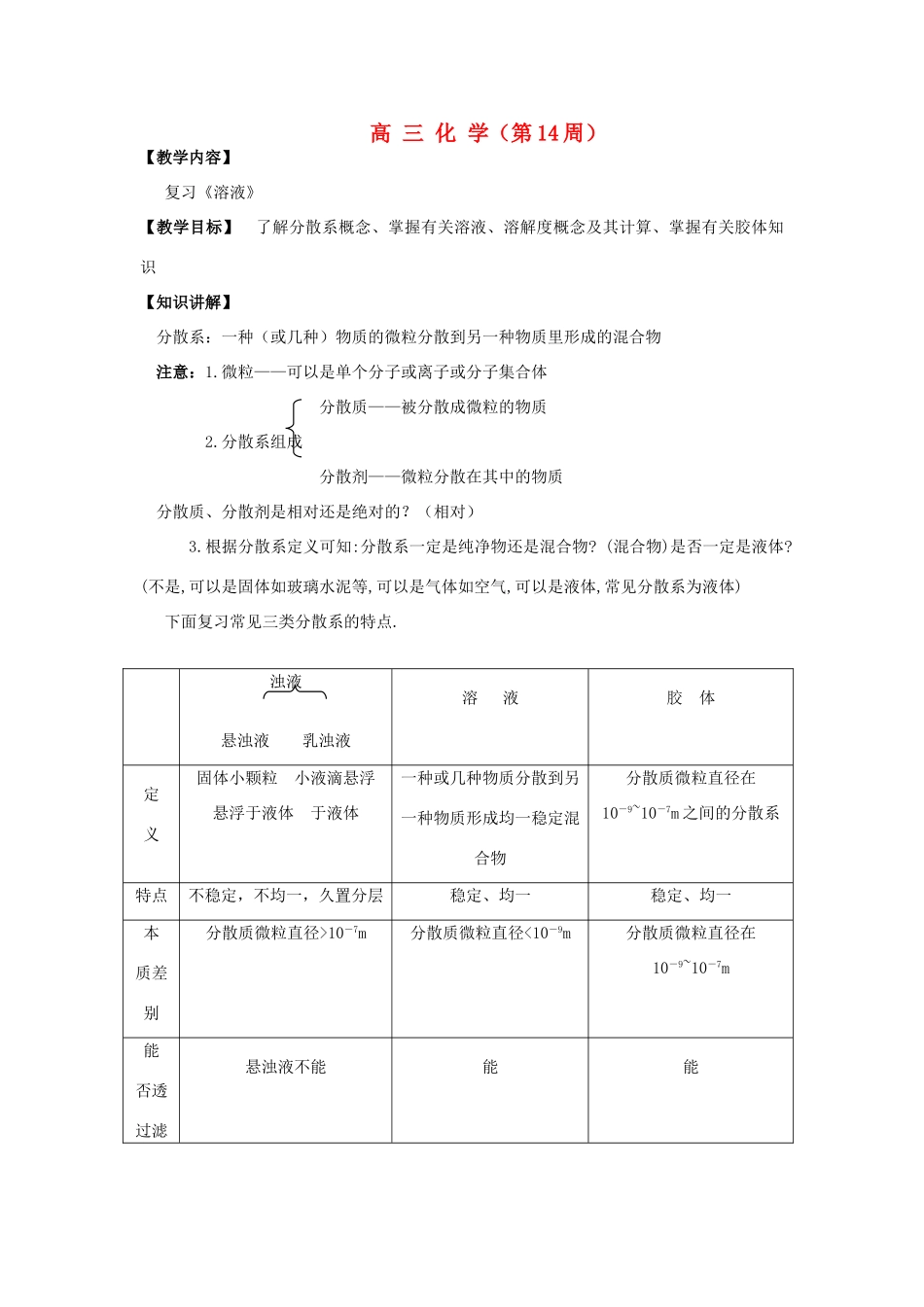
高 三 化 学(第 14 周)【教学内容】 复习《溶液》【教学目标】 了解分散系概念、掌握有关溶液、溶解度概念及其计算、掌握有关胶体知识[【知识讲解】 分散系:一种(或几种)物质的微粒分散到另一种物质里形成的混合物 注意:1.微粒——可以是单个分子或离子或分子集合体 分散质——被分散成微粒的物质 2.分散系组成 分散剂——微粒分散在其中的物质 分散质、分散剂是相对还是绝对的?(相对) 3.根据分散系定义可知:分散系一定是纯净物还是混合物? (混合物)是否一定是液体?(不是,可以是固体如玻璃水泥等,可以是气体如空气,可以是液体,常见分散系为液体) 下面复习常见三类分散系的特点.浊液悬浊液 乳浊液溶 液胶 体定 义固体小颗粒 小液滴悬浮悬浮于液体 于液体一种或几种物质分散到另一种物质形成均一稳定混合物分散质微粒直径在10-9~10-7m 之间的分散系特点不稳定,不均一,久置分层稳定、均一稳定、均一本 质差 别分散质微粒直径>10-7m分散质微粒直径<10-9m分散质微粒直径在10-9~10-7m能 否透 过滤 悬浊液不能能能纸能 否透 过半 透膜不能能能一. 胶体11.胶体制备——中学常用凝聚法(1) Fe(OH)3胶体:饱和 FeCl3溶液加到沸水中煮沸即得,利用了盐类水解原理制得 Fe3++3H2O △ Fe(OH)3(胶体) +3H+思路:制 Fe(OH)3胶体时,能否长时间煮沸?(不能,否则要凝聚)(2)AgI 胶体制备:将 AgNO3滴入 KI 溶液或将 KI 溶液滴入 AgNO3溶液,要成功制得 AgI 胶体关键是:两种溶液浓度均要很低(≤0.01mol/L).一种溶液过量(取 10ml),另一种溶液必须少量,只能用滴管滴加 8~10 滴,否则只能制得 AgI 沉淀.同学们头脑里一定存在这样一个问题:胶体的分散质实际上是不溶物,为什么久置并不沉淀下来?首先要明确:胶粒(分散质)是否是单个分子?一般不可能(除高分子溶液如蛋白质,淀粉等).通常均为分子集合体,即多个分子聚集而成,其次,胶粒半径小→其表面积大→吸附性强,可吸附与组成胶粒相同或相近的阴、阳离子→胶粒带有同种电荷,相互间斥力较大,因而不能凝聚形成沉淀.例1AgI 胶体制备,若将 0.01mol/LAgNO38—10 滴逐滴加入到 10ml 0.01mol/LKI 溶液中,则 AgI 胶粒吸附较多的 I-(KI 过量),胶粒带负电,若反之,则 AgI 胶粒吸附较多的 Ag+(AgNO3过量),胶粒带负电例2例 2 As2S3胶体制备方法是将稍过量的 H2S 气体通入到 H3AsO3中,3H2S+2H3AsO3=As2S3+6H2O,As2S3胶粒带...