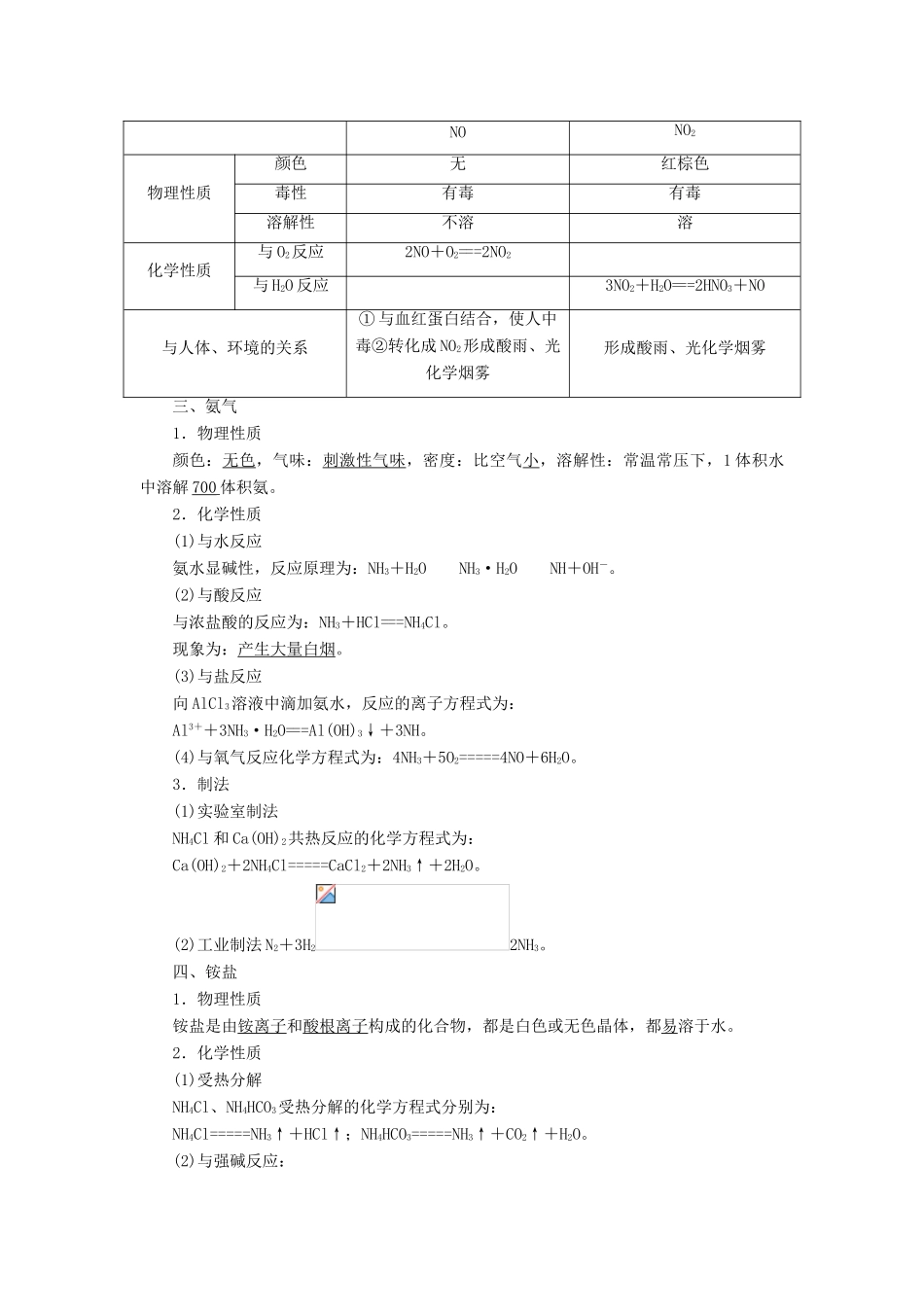
第 13 讲:氮及其化合物【内容与解析】本节课复习的内容是硫及其化合物的性质与应用。主要是两个内容:1 二氧化硫的性质。2 硫酸的性质。二氧化硫的性质主要体现在二氧化硫的四个性质上,酸性氧化物、二氧化硫的还原性、二氧化硫的氧化性、二氧化硫的漂白性。硫酸的性质上,主要是浓硫酸的三大特性:吸水性、脱水性、强氧化性。所以就在于这些性质的区别上。【教学目标与解析】1.教学目标1.了解氮元素单质及其重要化合物的主要性质和应用。2.了解氮元素单质及其重要化合物对环境质量的影响。2.目标解析1. 了解硫元素单质及其重要化合物的主要性质及应用。就是指二氧化硫的四个性质,浓硫酸的三大特性。2.了解硫元素单质及其重要化合物对环境质量的影响。就是指二氧化硫会造成酸雨,硫酸型酸雨,而且是随时间的变化酸雨的 PH 值会越来越小。所以就有酸雨的防护问题。【问题诊断分析】本节中学生感到困难的地方就是在于复习过程中,在浓硫酸的计算上,要掌握的是不能用浓硫酸的量来进行计算,因为浓硫酸的量一定要过量,所以就要搞清硫酸在计算过程中到底反应了多少物质这是硫酸计算的关键。再就是二氧化硫性的判断,很多同学会把二氧化硫的漂白性,与还原性搞不清楚,这就是要掌握,无机物质的颜色是不能漂白的。【教学条件支持】这节课主要是通过 PPT 这个手段,因为这样能加快复习的速度,节约复习的时间。特别是二氧化硫的四个性质与浓硫酸的三大特性上,这样,学生更能掌握这两种物质的性质。【复习过程】一、氮气1.物理性质通常情况下,N2为无色无味的气体,不溶于水。2.化学性质(1)与 O2反应:N2+O2=====2NO。(2)工业合成氨:N2+3H22NH3。(3)与 Mg 反应:3Mg+N2=====Mg3N2。二、氮的氧化物NONO2物理性质颜色无红棕色毒性有毒有毒溶解性不溶溶化学性质与 O2反应2NO+O2===2NO2与 H2O 反应3NO2+H2O===2HNO3+NO与人体、环境的关系① 与血红蛋白结合,使人中毒②转化成 NO2形成酸雨、光化学烟雾形成酸雨、光化学烟雾三、氨气1.物理性质颜色:无色,气味:刺激性气味,密度:比空气小,溶解性:常温常压下,1 体积水中溶解 700 体积氨。2.化学性质(1)与水反应氨水显碱性,反应原理为:NH3+H2ONH3·H2ONH+OH-。(2)与酸反应与浓盐酸的反应为:NH3+HCl===NH4Cl。现象为:产生大量白烟。(3)与盐反应向 AlCl3溶液中滴加氨水,反应的离子方程式为:Al3++3NH3·H2O===Al(OH)3↓+3NH。(4)与氧气反应化学...