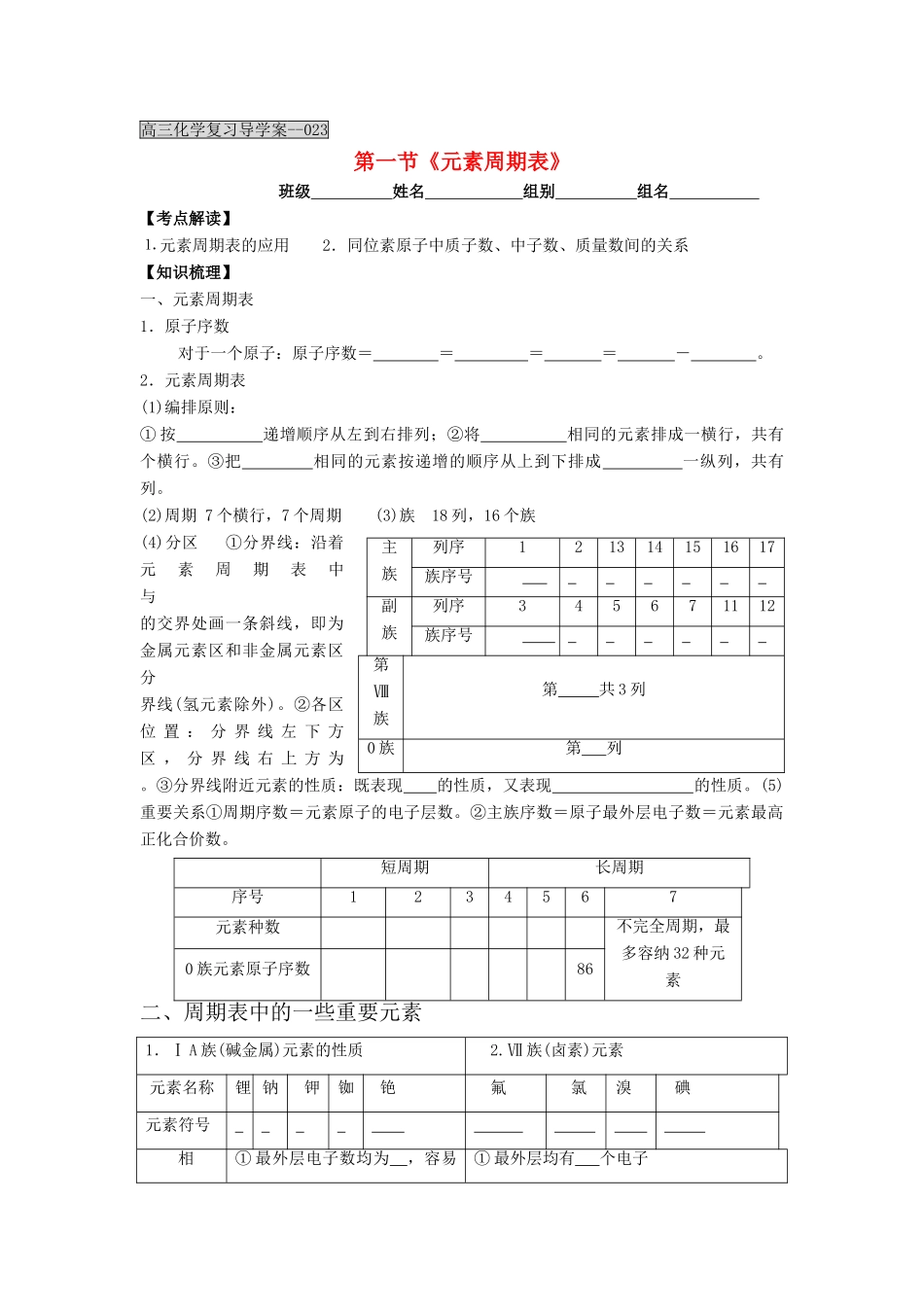
高三化学复习导学案--023第一节《元素周期表》班级 姓名 组别 组名 【考点解读】⒈ 元素周期表的应用 2.同位素原子中质子数、中子数、质量数间的关系 【知识梳理】一、元素周期表1.原子序数对于一个原子:原子序数= = = = - 。2.元素周期表(1)编排原则:① 按 递增顺序从左到右排列;②将 相同的元素排成一横行,共有 个横行。③把 相同的元素按递增的顺序从上到下排成 一纵列,共有 列。(2)周期 7 个横行,7 个周期 (3)族 18 列,16 个族(4)分区 ①分界线:沿着元素周期表中 与 的交界处画一条斜线,即为金属元素区和非金属元素区分界线(氢元素除外)。②各区位 置 : 分 界 线 左 下 方 区 , 分 界 线 右 上 方 为 。③分界线附近元素的性质:既表现 的性质,又表现 的性质。(5)重要关系①周期序数=元素原子的电子层数。②主族序数=原子最外层电子数=元素最高正化合价数。短周期长周期序号1234567元素种数不完全周期,最多容纳 32 种元素0 族元素原子序数86二、周期表中的一些重要元素1.Ⅰ A 族(碱金属)元素的性质2.Ⅶ 族(卤素)元素 元素名称锂 钠钾铷铯氟氯溴碘元素符号 相① 最外层电子数均为 ,容易 ① 最外层均有 个电子主族列序121314151617族序号 副族列序345671112族序号 第Ⅷ族第 共 3 列0 族第 列似性电子② 最 高 正 化 合 价 均 为 价③ 碱金属元素的单质均能与氧气等非金属单质反应,生成相应的氧化物等碱金属化合物④ 均能与水、酸剧烈反应,生成 和相应的碱、盐② 最高正价(除 F 外)均显 价③ 最低负价均为 价④ 单质均可与 H2反应生成气态 ⑤ 单质均可与 反应,生成相应的金属卤化物 递变性①电子层数 ②原子半径 ③ 金属性 ④ 氢氧化物的碱性 ① 电 子 层 数 ② 原 子 半 径 ③单质颜色自上而下 ④单质与H2化合按 的顺序依次由易到 难 ⑤ 气 态 氢 化 物 的 稳 定 性 , 按 的顺序递减⑥ 单质与 H2O 反应的难易程度:由 到 三、核素、同位素1.原子的表示方法 2.微粒间的基本关系(1)对于原子 质量数(A)= 。质子数= = 。(2)对于离子 离子所带电荷=质子数- 。3.核素和同位素(1)核素:具有一定数目 和一定数目的一种原子,可用符号 表示。(2)同位素: 相同而 不同的同一种元素的不同核素互称为同位素。(3)同位素的特征① 同位素化学性质几乎完全 。②在自然...