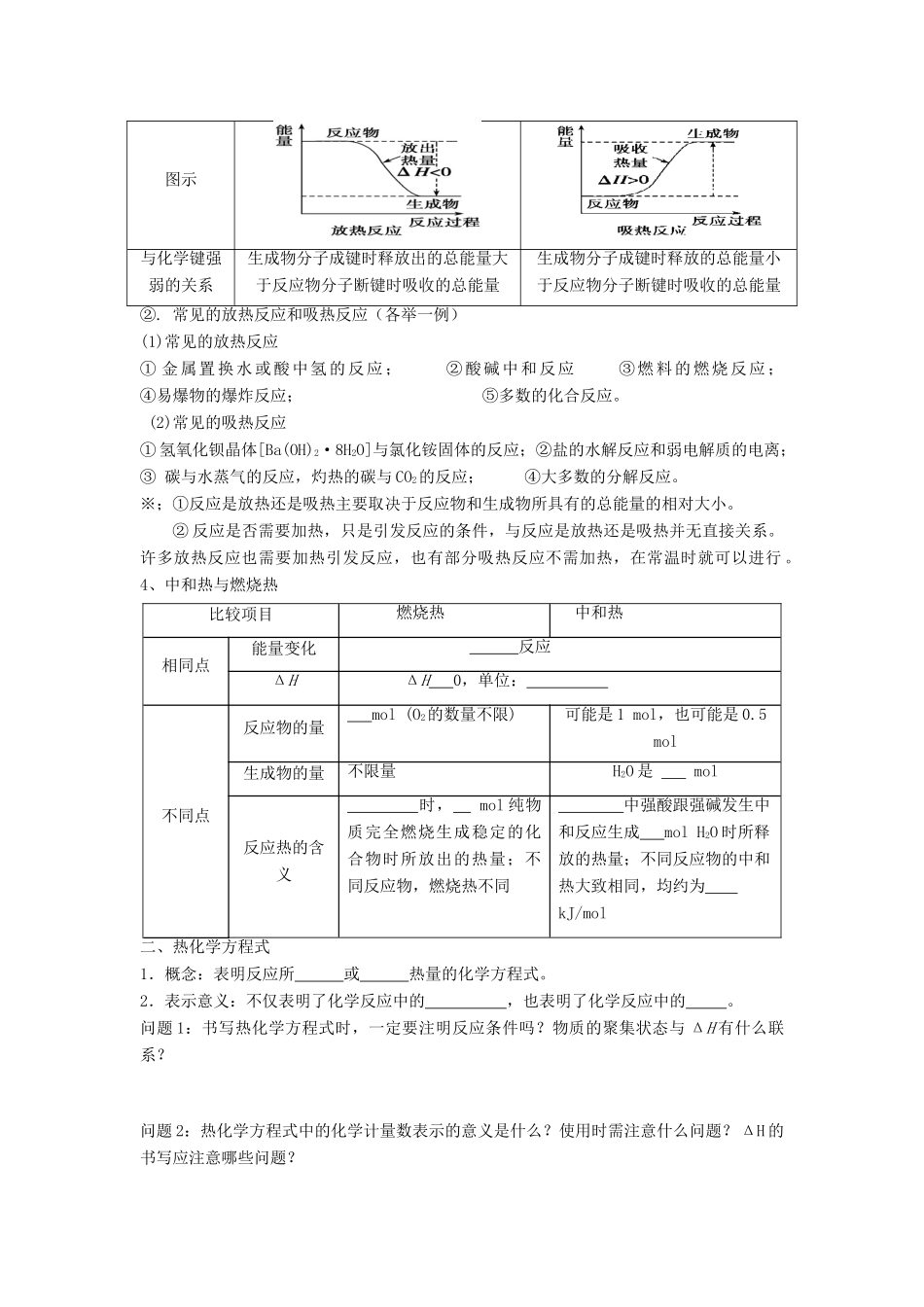
高三化学复习-导学案-027第一节《化学反应中的能量变化》 班级 姓名 组别 组名 【考纲解读】:1. 了解焓变、吸(放)热反应、反应热、中和热、燃烧热等概念2. 利用反应物、生成物的能量或键能数据来判断放热反应或吸热反应3. 正确书写热化学方程式或判断热化学方程式的正误【知识梳理】:一、反应热与焓变1.反应热(1)反应热的概念、表示方法① 概念:当化学反应在一定 下进行时,反应所 的热量。② 表示方法:用 Q 表示,若 表示吸热,若 表示放热。(2)反应热产生的原因在化学反应过程中,旧化学键断裂要 能量,新化学键形成要 能量,从而引起反应过程中能量的变化。(3)反应热的测定① 仪器: 。② 原理:恒温、恒压下,ΔH=Q=- ,式中 c 代表仪器和反应混合物的比热容,单位是 J/(g·℃)。2.焓与焓变(1)焓:用于描述 的物理量,符号 。(2) 焓 变 (ΔH) : 反 应 产 物 的 与 反 应 物 的 之 差 。 即 ΔH = 。(3)焓变(ΔH)与反应热(Q)的关系对于等温、 条件下的化学反应,如果反应中物质的能量全部转化为 (没有转化为 等其他形式的能),则反应前后物质的 等于该反应的反应热。即 ΔH= 。3. 吸热反应与放热反应的比较①.吸热反应和放热反应的比较 放热反应吸热反应定义放出热量的化学反应吸收热量的化学反应形成原因反应物具有的总能量大于生成物具有的总能量反应物具有的总能量小于生成物具有的总能量表示方法ΔH<0ΔH>0图示与化学键强弱的关系生成物分子成键时释放出的总能量大于反应物分子断键时吸收的总能量生成物分子成键时释放的总能量小于反应物分子断键时吸收的总能量②. 常见的放热反应和吸热反应(各举一例)(1)常见的放热反应① 金属置换水或酸中氢的反应; ②酸碱中和反应 ③燃料的燃烧反应; ④易爆物的爆炸反应; ⑤多数的化合反应。 (2)常见的吸热反应① 氢氧化钡晶体[Ba(OH)2·8H2O]与氯化铵固体的反应;②盐的水解反应和弱电解质的电离;③ 碳与水蒸气的反应,灼热的碳与 CO2的反应; ④大多数的分解反应。※;①反应是放热还是吸热主要取决于反应物和生成物所具有的总能量的相对大小。② 反应是否需要加热,只是引发反应的条件,与反应是放热还是吸热并无直接关系。许多放热反应也需要加热引发反应,也有部分吸热反应不需加热,在常温时就可以进行 。4、中和热与燃烧热比较项目燃烧热 中和热相同点能量变化 反应ΔHΔH 0,单位: 不同点反...