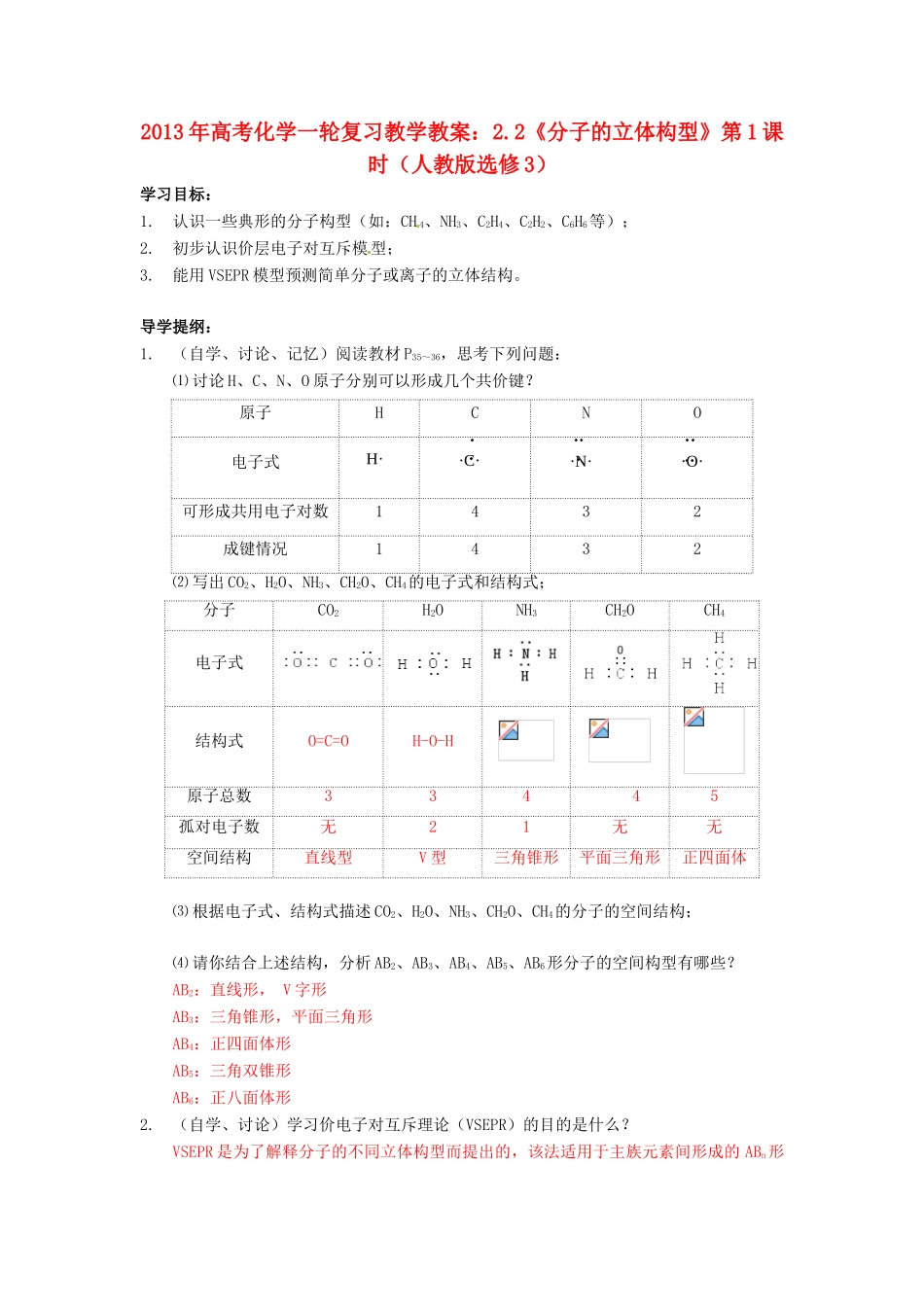
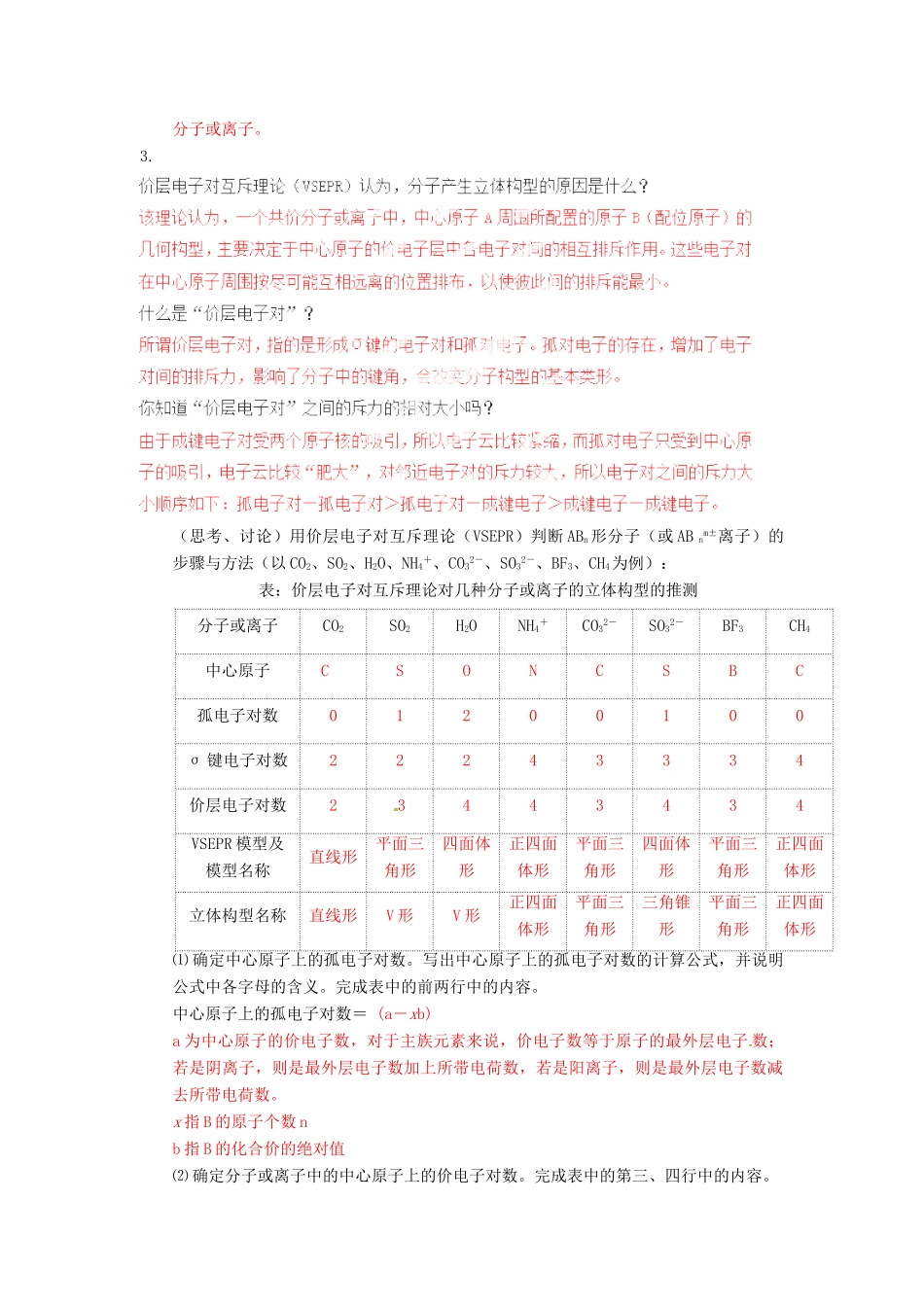
2013 年高考化学一轮复习教学教案:2.2《分子的立体构型》第 1 课时(人教版选修 3)学习目标:1.认识一些典形的分子构型(如:CH 4、NH3、C2H4、C2H2、C6H6等);2.初步认识价层电子对互斥模型;3.能用 VSEPR 模型预测简单分子或离子的立体结构。导学提纲:1.(自学、讨论、记忆)阅读教材 P35~36,思考下列问题:⑴ 讨论 H、C、N、O 原子分别可以形成几个共价键?原子HCNO电子式H·可形成共用电子对数1432成键情况1432⑵ 写出 CO2、H2O、NH3、CH2O、CH4的电子式和结构式;分子CO2H2ONH3CH2OCH4电子式结构式O=C=OH-O-H原子总数33445孤对电子数无21无无空间结构直线型V 型三角锥形平面三角形正四面体⑶ 根据电子式、结构式描述 CO2、H2O、NH3、CH2O、CH4的分子的空间结构;⑷ 请你结合上述结构,分析 AB2、AB3、AB4、AB5、AB6形分子的空间构型有哪些?AB2:直线形, V 字形AB3:三角锥形,平面三角形AB4:正四面体形AB5:三角双锥形AB6:正八面体形2.(自学、讨论)学习价电子对互斥理论(VSEPR)的目的是什么?VSEPR 是为了解释分子的不同立体构型而提出的,该法适用于主族元素间形成的 ABn形·C··N··O·分子或离子。3.(思考、讨论)用价层电子对互斥理论(VSEPR)判断 ABn形分子(或 AB nm±离子)的步骤与方法(以 CO2、SO2、H2O、NH4+、CO32-、SO32-、BF3、CH4为例):表:价层电子对互斥理论对几种分子或离子的立体构型的推测分子或离子CO2SO2H2ONH4+CO32-SO32-BF3CH4中心原子C[]SONCSBC孤电子对数01200100σ 键电子对数22243334价层电子对数23443434VSEPR 模型及模型名称直线形平面三角形四面体形正四面体形平面三角形四面体形平面三角形正四面体形立体构型名称直线形V 形V 形正四面体形平面三角形三角锥形平面三角形正四面体形⑴ 确定中心原子上的孤电子对数。写出中心原子上的孤电子对数的计算公式,并说明公式中各字母的含义。完成表中的前两行中的内容。中心原子上的孤电子对数= (a-xb)a 为中心原子的价电子数,对于主族元素来说,价电子数等于原子的最外层电子 数;若是阴离子,则是最外层电子数加上所带电荷数,若是阳离子,则是最外层电子数减去所带电荷数。x 指 B 的原子个数 nb 指 B 的化合价的绝对值⑵ 确定分子或离子中的中心原子上的价电子对数。完成表中的第三、四行中的内容。中心原子上的价电子对数=σ 键电子对+孤电子对 σ 键电子对等于 n⑶ 确定 VSEPR ...