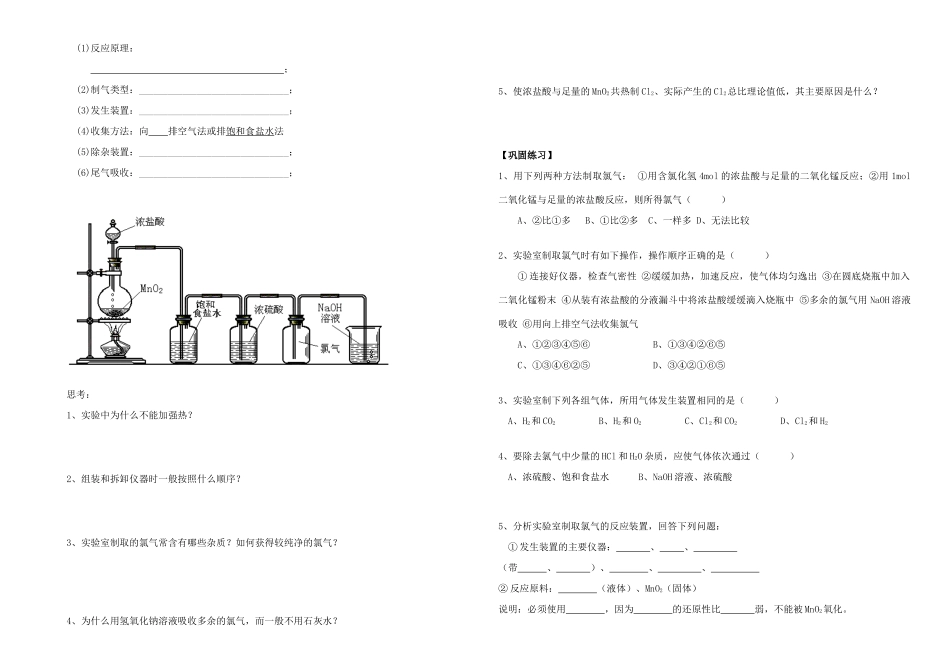
2014 年高中化学 专题二 从海水中获得的化学物质 氯气的生产原理导学案 苏教版必修 1 [使用说明与学法指导]1.先使用 10 分钟完成预习自学本节知识,请同学们认真阅读课本 p40-41,划出重要知识点,规范完成学案,预习自学内容并熟记基础知识,用红色笔做好疑难标记。2.联系课本知识和学过的知识,小组合作讨论完成学案合作探究内容;组长负责,拿出讨论结果,准备展示和点评。【学习目标】 知识与技能 1.了解从海水中提取氯气的基本原理和方法。2.掌握电解饱和食盐水的原理,了解工业上阳离子交换膜法电解食盐水的装置。3.掌握实验室制备氯气的原料和原理、发生装置、净化装置等,并能从氧化还原反应角度分析反应。【教学重点】 氯碱工业生产原理【教学难点】 电解食盐水产物的判断过程与方法 通过实验探究,让学生学会运用实验、观察、分析实验现象等手段对氯气的制法进行研究,从而引导学生通过观察物质、研究物质等感性认识,进而上升到理性认识。情感态度与价值观 让学生进一步了解化学与生活的关系,化学知识的学以致用以及从日常生活提炼化学知识。预习自学案请阅读教材 P40 前言并思考:1.海水中主要含有的物质和各元素的含量。2.被称为“海洋元素”的是哪种元素?3.人们是如何从海水中获得氯化钠并生产氯气的。4.什么是氯碱工业? 氯碱工业反应原理:_________________________ 如何检验生成的气体?课内探究案一、氯气的工业制法〖演示实验〗请同学们认真观察、记录并分析实验现象。〖交流讨论 1〗实验现象结论1通电后两极均产生气泡 通电后有新的气体物质生成2将铁棒上方收集到的气体靠近火焰,有轻微的爆鸣声与电源负极相连的电极(阴极)产物为 3B 导管口有黄绿色、刺激性气味的气体产生,该气体能使湿润的淀粉碘化钾试纸变蓝与电源正极相连的电极(阳极)产物为 4,向溶液中滴加 1~2 滴酚酞溶液,与电源负极相连的一端溶液变 电解后溶液呈 〖随堂练习 1〗电解饱和食盐水化学方程式: 〖随堂练习 2〗工业上使用的原料粗盐中常含有泥沙、Ca2+、Mg2+、Fe3+、SO42— 等杂质,在碱性溶液中会形成沉淀,损坏离子交换膜,所以必须要对粗盐水进行净化。其步骤包括:①过滤除去泥沙。②加入稍过量的 BaCl2(或氢氧化钡)溶液以除去 SO42—。③加入稍过量的 Na2CO3溶液以除去 Ca2+、Ba2+。④加入稍过量的 NaOH 溶液以除去 Mg2+、Fe3+。⑤过滤以除去上述产生的沉淀。⑥加入盐酸,调整溶液的 pH≈7...