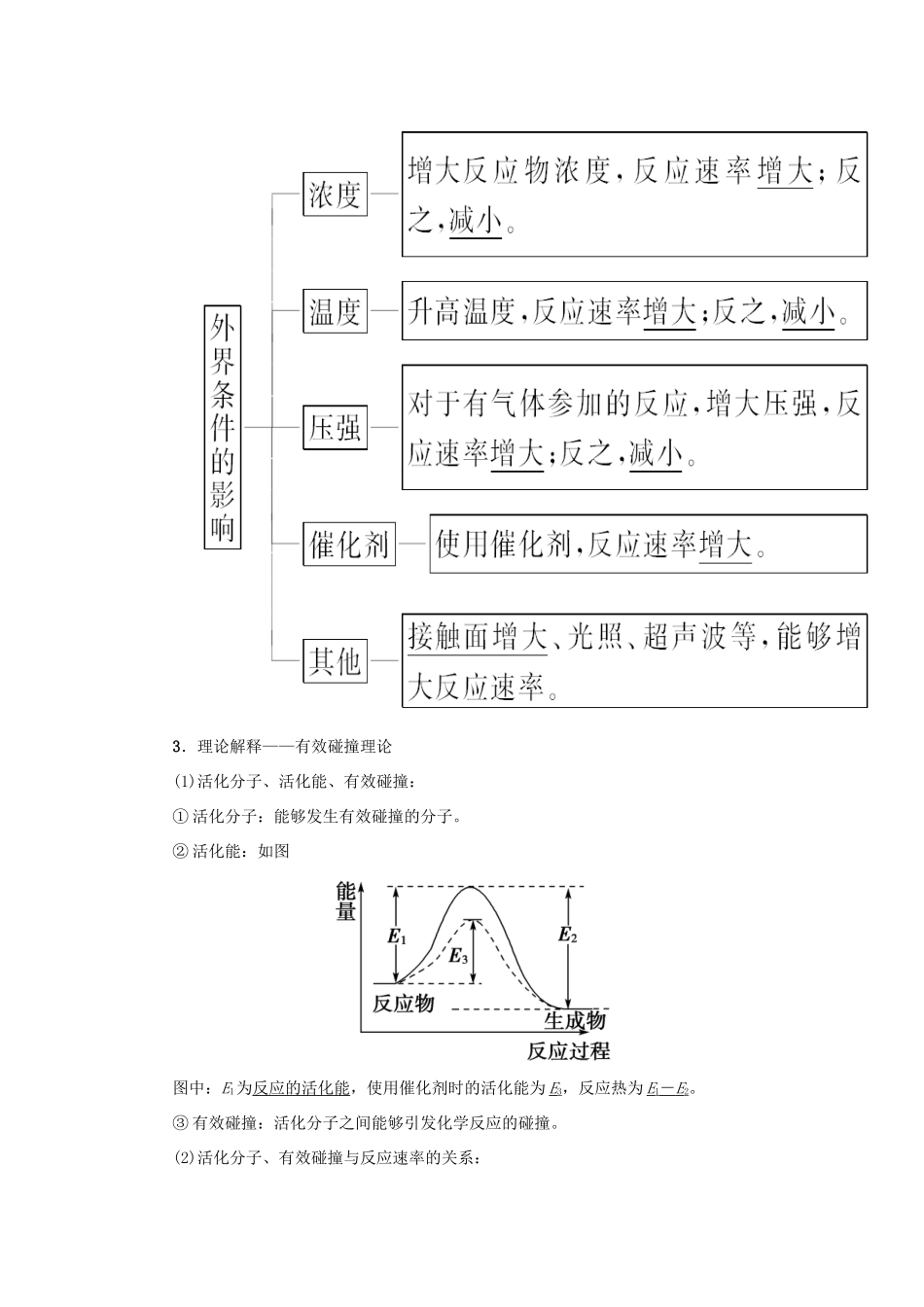
2015 届高考化学大一轮复习 第七章 第一节 化学反应速率(含解析)第一节 化学反应速率1.了解化学反应速率的概念、反应速率的定量表示方法。(高频)2.了解催化剂在生产、生活和科学研究领域中的重要作用。3.理解外界条件(浓度、温度、压强、催化剂等)对反应速率的影响,认识并能用相关理论解释其一般规律。(高频)4.了解化学反应速率的调控在生活、生产和科研领域中的重要作用。(中频) 化学反应速率1.概念2.化学反应速率与化学计量数关系对于已知反应 mA(g)+nB(g)pC(g)+qD(g),其化学反应速率可用不同的反应物或生成物来表示,当单位相同时,化学反应速率的数值之比等于化学计量数之比,即 v(A)∶v(B)∶v(C)∶v(D)=m ∶ n ∶ p ∶ q 。3.反应速率的实验测定(1)原则:任何一种化学物质的浓度(或质量)有关的性质在测量反应速率时都可以加以利用。(2)测定的角度① 直接观察的某些性质,如放出气体的体积和体系压强;② 依靠科学仪器测量的性质,如颜色深浅、光的吸收、光的发射、导电能力等;③ 溶液中利用颜色深浅与显色物质浓度间的正比关系,测量反应速率。 影响化学反应速率的因素1.内因反应物本身的性质是主要因素。如相同条件下 Mg、Al 与稀盐酸反应的速率大小关系为Mg>Al。2.外因3.理论解释——有效碰撞理论(1)活化分子、活化能、有效碰撞:① 活化分子:能够发生有效碰撞的分子。② 活化能:如图图中:E1为反应的活化能,使用催化剂时的活化能为 E3,反应热为 E1- E 2。③ 有效碰撞:活化分子之间能够引发化学反应的碰撞。(2)活化分子、有效碰撞与反应速率的关系:1.易误诊断(正确的打“√”,错误的打“×”)。(1)对于 C(s)+H2O(g)H2(g)+CO(g)反应 v(C)=v(H2O)( )(2)化学反应速率一定随着时间的延长而减小( )(3)决定化学反应速率快慢的根本因素是温度、浓度和催化剂( )(4)0.1 mol·L-1的盐酸和 0.1 mol·L-1的 HNO3分别与大小相同的大理石反应的速率相同( )(5)Mg 和 Fe 与 0.1 mol·L-1的盐酸反应速率相同( )(6)大理石块与大理石粉分别与 0.1 mol·L-1的盐酸反应的速率相同( )(7)升高温度,可以增加活化分子百分数,使反应速率加快( )(8)增大反应物浓度可以增加活化分子百分数,使反应速率加快( )(9)双氧水中加入 MnO2,可以使生成 O2的速率增大,是因为 MnO2的催化作用( )(10)同时改变两个变量来研究反应速率的变化,能更快得出有关规律( )【答案】 (1)×...