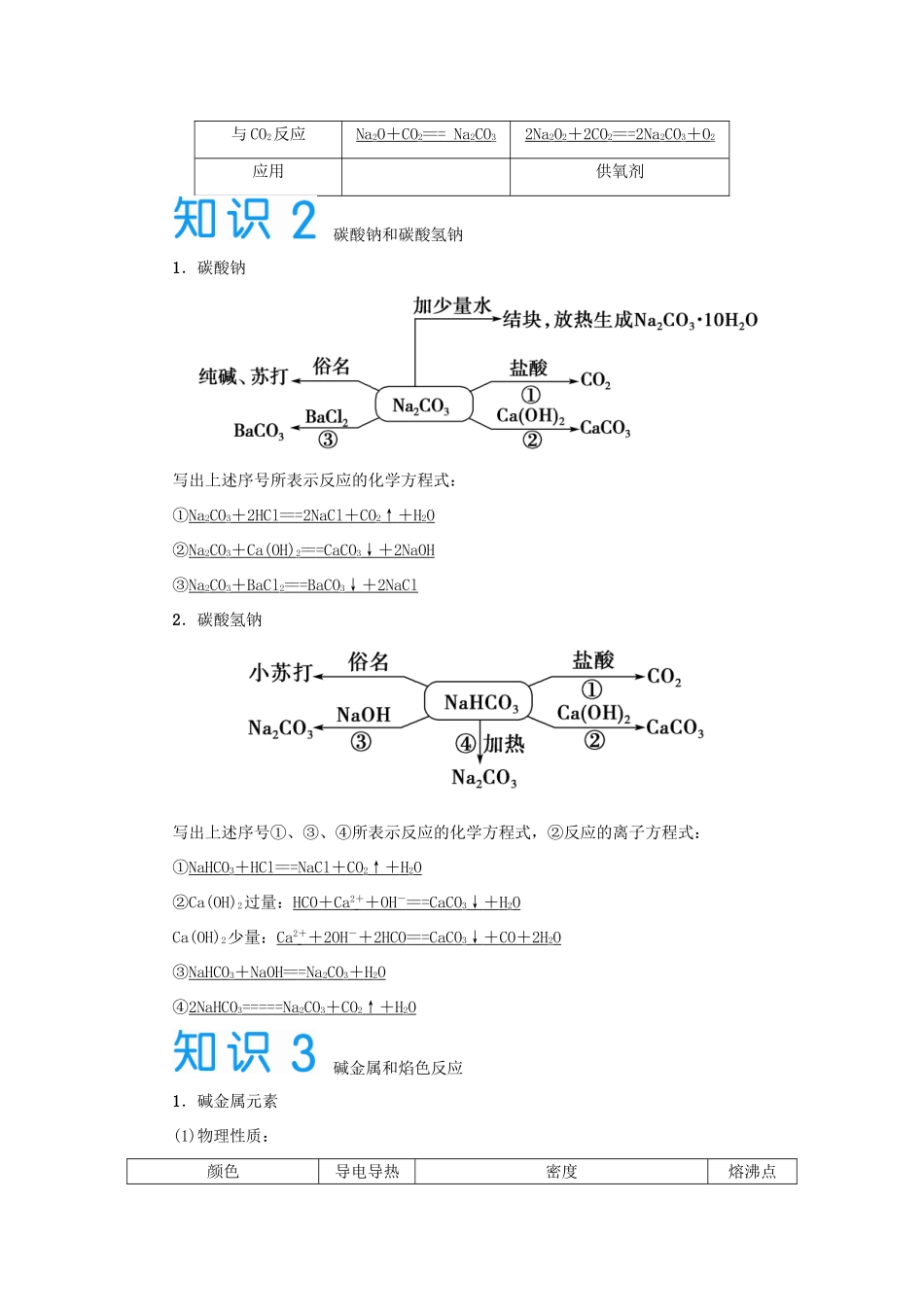
2015 届高考化学大一轮复习 第三章 第一节 钠及其化合物 碱金属(含解析)第一节 钠及其化合物 碱金属1.了解钠的主要性质及其用途。(中频)2.了解钠的重要化合物(Na2O2、NaOH、Na2CO3、NaHCO3等)的主要性质及其用途。(高频)3.了解碱金属的性质相似性和递变性。 钠及其氧化物1.钠的主要性质及保存钠2.氧化钠和过氧化钠化学式Na2ONa2O2阳、阴离子个数比Na+与 O2-之比为2∶1Na+和 O 之比为 2∶1氧的化合价-2- 1 颜色白色淡黄色与 H2O 反应Na2O + H 2O == =2NaOH 2Na2O2+ 2H 2O == =4NaOH + O 2↑与 CO2反应Na2O + CO 2== = Na 2CO32Na2O2+ 2CO 2== =2Na 2CO3+ O 2应用供氧剂 碳酸钠和碳酸氢钠1.碳酸钠写出上述序号所表示反应的化学方程式:①Na2CO3+ 2HCl == =2NaCl + CO 2↑ + H 2O②Na2CO3+ Ca(OH) 2== =CaCO 3↓ + 2NaOH ③Na2CO3+ BaCl 2== =BaCO 3↓ + 2NaCl 2.碳酸氢钠写出上述序号①、③、④所表示反应的化学方程式,②反应的离子方程式:①NaHCO3+ HCl == =NaCl + CO 2↑ + H 2O②Ca(OH)2过量:HCO + Ca 2 + + OH - == =CaCO 3↓ + H 2OCa(OH)2少量:Ca 2 + + 2OH - + 2HCO == =CaCO 3↓ + CO + 2H 2O③NaHCO3+ NaOH == =Na 2CO3+ H 2O④2NaHCO3===== Na 2CO3+ CO 2↑ + H 2O 碱金属和焰色反应1.碱金属元素(1)物理性质:颜色导电导热密度熔沸点性银白色(铯略带金色光泽)良好Li→Cs:呈增大趋势,但ρ(K)<ρ(Na)逐渐降低(2)化学性质:钾与水反应的化学方程式为: 2K+2H2O===2KOH+H22.焰色反应(1)概念:很多金属或它们的化合物在灼烧时都会使火焰呈现特殊的颜色,属于物理变化,属于元素的性质,应用于检验某些元素的存在。(2)常见元素的焰色钠元素:黄色;钾元素:浅紫色(透过蓝色钴玻璃)。(3)操作步骤铂丝――→火焰无色―→蘸取待测物――→观察火焰颜色注意:洗涤铂丝用稀 HCl 溶液洗涤,然后在火焰上灼烧,火焰为无色,说明铂丝洗净。1.易误诊断(正确的打“√”,错误的打“×”)。(1)钠是一种强还原剂,在自然界中只能以化合态存在( )(2)钠能把 FeSO4溶液中的 Fe 置换出来( )(3)钠与 O2反应只能生成 Na2O2( )(4)潜水艇紧急情况下可以用 Na2O2作供氧剂( )(5)Na2O 和 Na2O2均为碱性氧化物( )(6)澄清石灰水可用于鉴别 Na2CO3和 NaHCO3溶液( )(7)Na2CO...