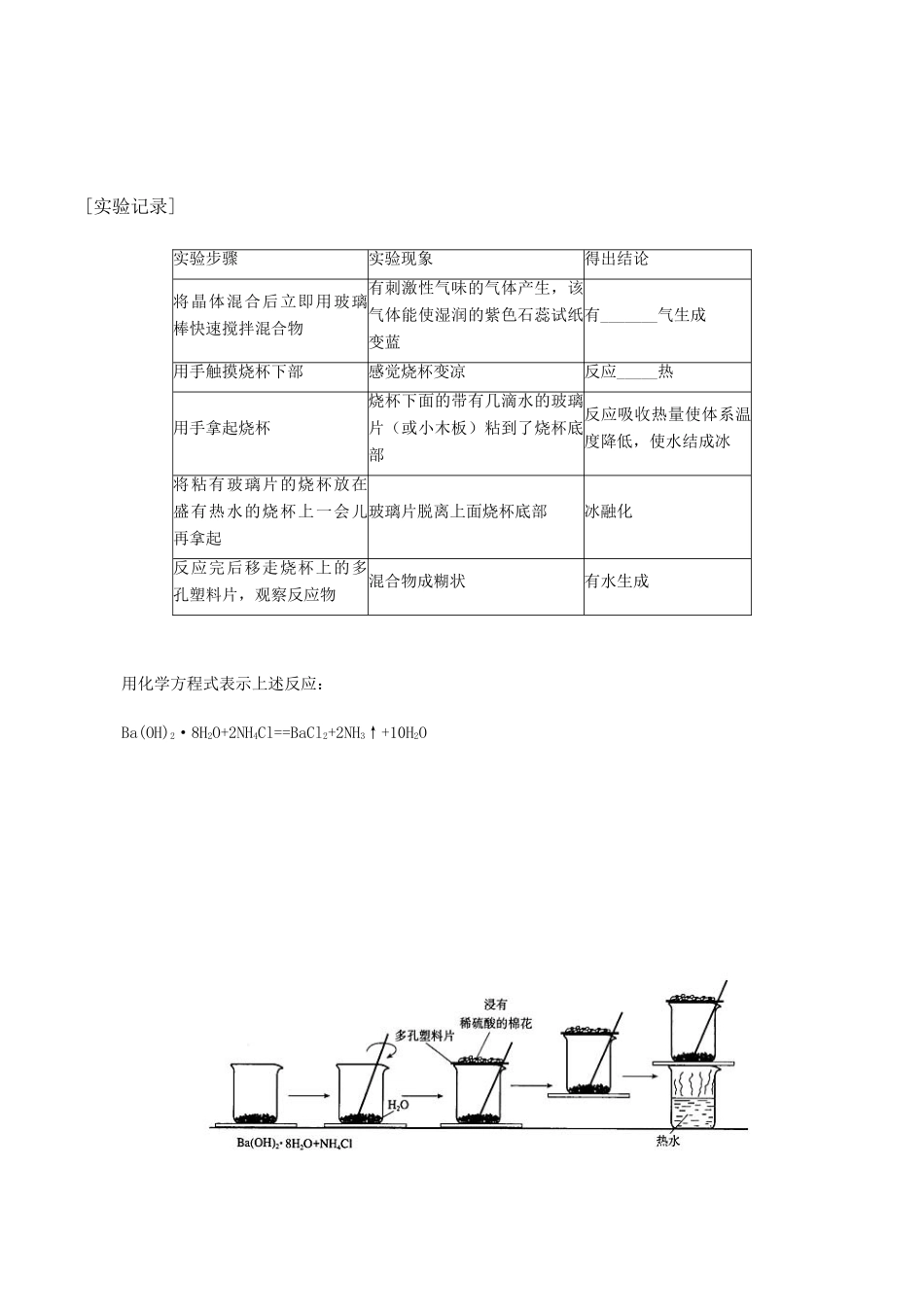
2015 年春高中化学(基础知识+自主探究+探求新知+拓展提升)2.1 化学能与热能预习案 新人教版必修 2【学习目标】1.知道化学键的断裂和形成是化学反应中能量变化的主要原因2.通过生产、生活中的实例了解化学能与热能的相互转化3.理解中和热的概念,学会定性和定量的研究化学反应中热量变化的科学方法2.拓宽学生的科学视野,使学生建立正确的能量观,提高节能意识。【学习重点】化学能与热能之间的内在联系以及化学能与热能的相互转化[基础知识]一、化学键与化学反应中能量变化的关系[复习] 化学键:_____________________________________________*键能:拆开 1 mol 某键所需的能量叫键能。单位:kJ/mol。化学键的形成蕴涵着能量变化,在进行反应时化学键要断裂,吸收能量,反应后形成新化学键要放出能量,反应前反应物能量与反应后生成物能量不相等。[分析]2H→H2中能量变化?1mol H2中含有 1molH-H,在 250C 101kPa 条件下,由 H 原子形成 1molH-H 要_______436kJ 的能量,而断开 1molH-H 重新变为 H 原子要_______436kJ 的能量。[类比分析]CH4→4C+4H(吸收 4mol×415kJ/mol=1660kJ)[小结]:化学键的_____________是化学反应中能量变化的主要原因。 [小结]:化学反应的特点:1.有新物质生成,新物质和反应物总能量不同。2.反应中要遵循能量守恒。3.反应物与生成物的能量差若以热能形式表现即为放热和吸热。如果二者能量比较接近,则放热和吸热不明显。[讨论]为什么有的化学反应会放出热量,而有的化学反应却需要吸收热量呢?[结论] 一个确定的化学反应在发生过程中是吸收能量还是放出能量,决定于反应物的_________与生成物的_________的相对大小∑E(反应物)_______∑E(生成物)——放出能量∑E(反应物)________∑E(生成物)——吸收能量二、化学能与热能的相互转化 放热反应:______热的化学反应 放热反应: 热的化学反应化学反应 吸热反应:______热的化学反应[实验 2-1] [实验记录] 实验步骤*眼睛看到的现象 用手触摸的感觉用温度计测量的数据在一支试管中加入 2~3mL 6mol/L 的盐酸溶液 向含有盐酸溶液的试管中插入用砂纸打磨光的铝条 结 论[思考讨论]1.铝与盐酸反应的化学方程式: ___________________ 。2.在反应过程中你将能看到什么现象?3.用眼睛不能直接观察到反应中的热量变化。采取哪些简单易行的办法?4.要明显的感知或测量反应中的热量变化,在实验中应注意哪些问题?...