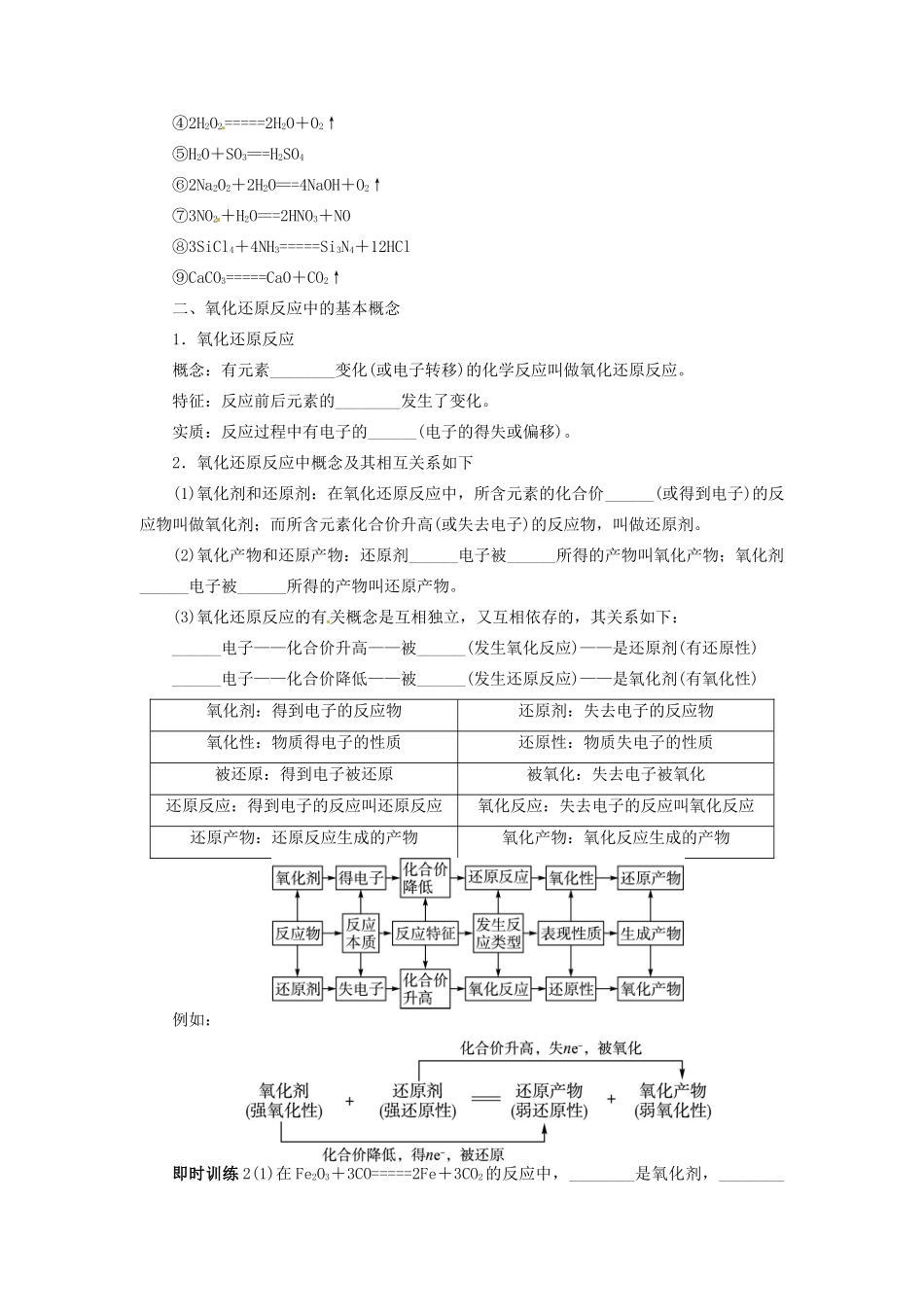
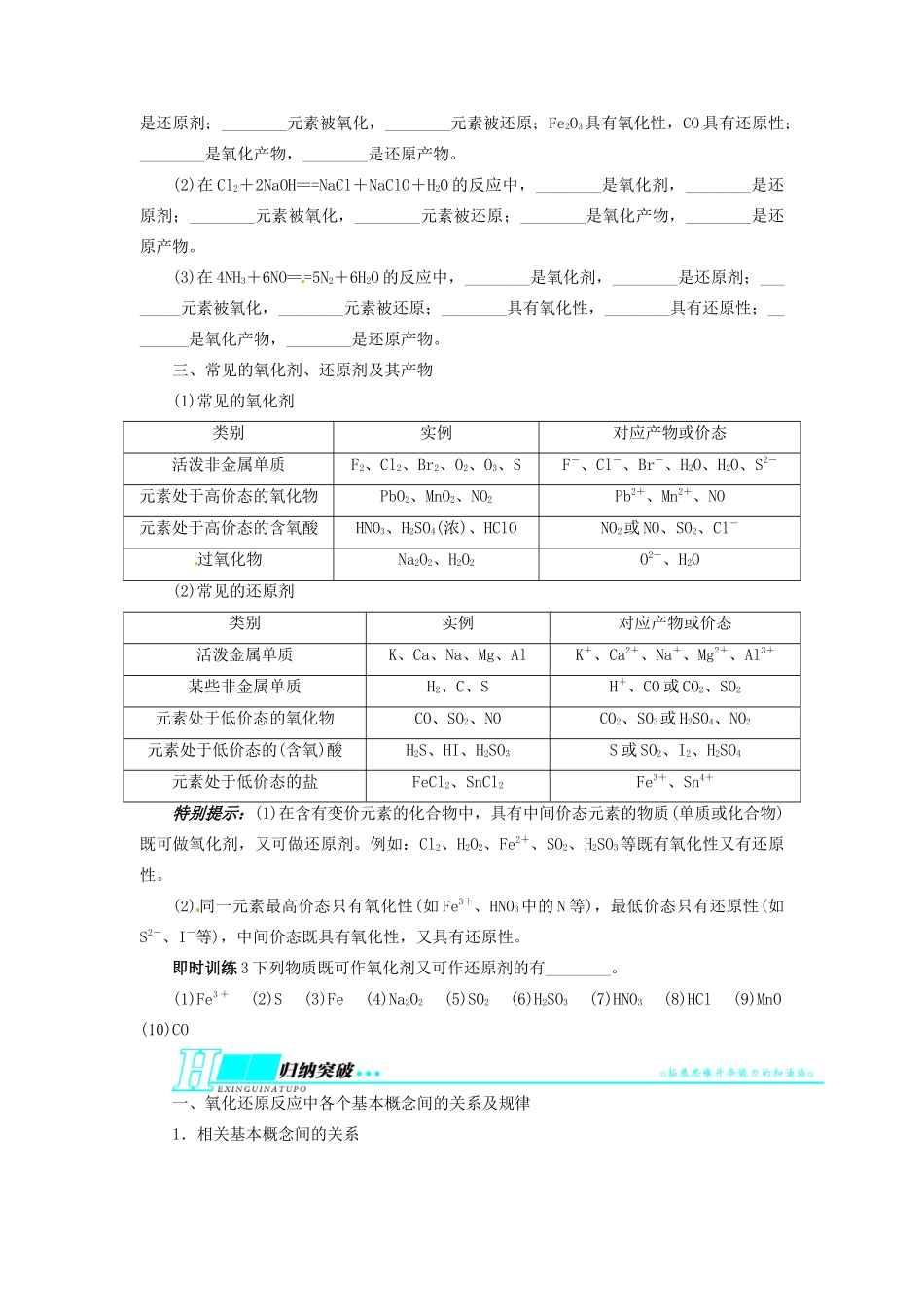
第三节 氧化剂和还原剂考纲点击1.了解氧化还原反应的本质是电子的转移。2.了解常见的氧化还原反应。3.掌握氧化还原反应方程式的简单配平方法。4.能利用电子守恒原理进行相关计算。一、化学反应的分类1.根据反应物和生成物的类别和反应前后物质种类的多少可分为化合、______、______、________反应。2.根据化合价是否发生变化(是否发生电子转移)可分为__________反应、__________反应。3.根据______变化,可分为放热反应和吸热反应。4.根据__________________,可分为不可逆反应和可逆反应。5.根据是否有离子参与,可分为非离子反应和离子反应。6.氧化还原反应与四大基本反应类型的关系可以下图表示:(1)置换反应都是氧化还原反应。(2)化合反应不都是氧化还原反应,有单质参加的化合反应是氧化还原反应。(3)分解反应不都是氧化还原反应,有单质生成的分解反应才是氧化还原反应。(4)复分解反应都不是氧化还原反应。特别提示:(1)有单质参加的化合反应或有单质生成分解反应一定是氧化还原反应,但有单质参加或生成的反应不一定是氧化还原反应。如:2O3===3O2不是氧化还原反应。(2)无单质参加的化合反应不一定都是非氧化还原反应。如:Na2O2+SO2===Na2SO4是氧化还原反应。即时训练 1 下列反应属于氧化还原反应的是________;属于化合反应的是________;属于分解反应的是________;属于置换反应的是________;属于复分解反应的是________。①TiCl4+2Mg=====2MgCl2+Ti②3O2=====2O3③2Fe+3Cl2=====2FeCl3④2H2O2=====2H2O+O2↑⑤H2O+SO3===H2SO4⑥2Na2O2+2H2O===4NaOH+O2↑⑦3NO2+H2O===2HNO3+NO⑧3SiCl4+4NH3=====Si3N4+12HCl⑨CaCO3=====CaO+CO2↑二、氧化还原反应中的基本概念1.氧化还原反应概念:有元素________变化(或电子转移)的化学反应叫做氧化还原反应。特征:反应前后元素的________发生了变化。实质:反应过程中有电子的______(电子的得失或偏移)。2.氧化还原反应中概念及其相互关系如下(1)氧化剂和还原剂:在氧化还原反应中,所含元素的化合价______(或得到电子)的反应物叫做氧化剂;而所含元素化合价升高(或失去电子)的反应物,叫做还原剂。(2)氧化产物和还原产物:还原剂______电子被______所得的产物叫氧化产物;氧化剂______电子被______所得的产物叫还原产物。(3)氧化还原反应的有关概念是互相独立,又互相依存的,其关系如下:______电子——化合价升高——被______(发生氧化反应)——是还原剂(有还原性)_...