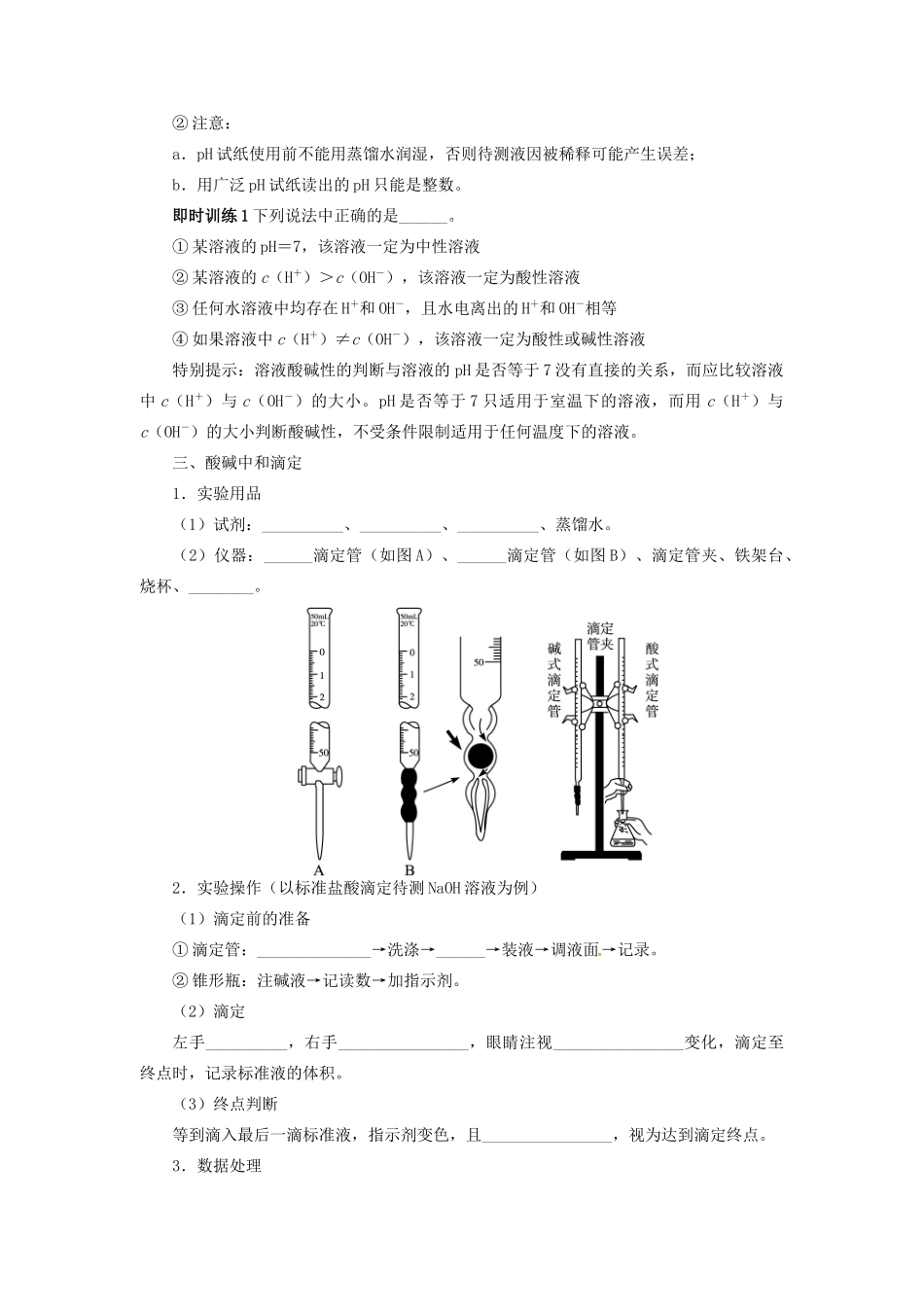
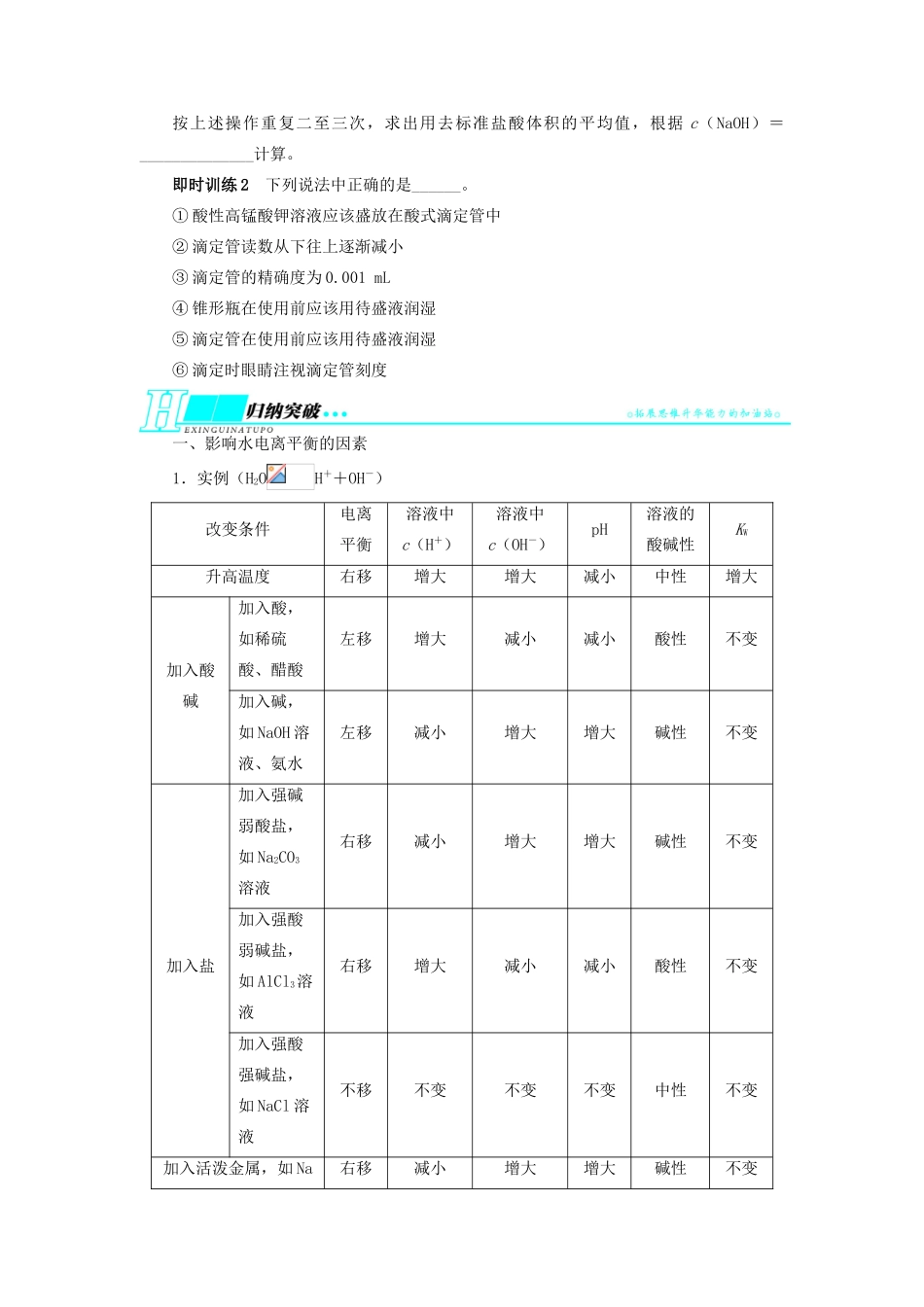
第 2 节 水的电离和溶液的酸碱性1.了解水的电离,离子积常数。2.了解溶液 pH 的定义。3.了解测定溶液 pH 的方法,能进行 pH 的简单计算。一、水的电离和水的离子积常数1.电离方程式水是一种极弱的电解质,其电离方程式为__________________________。2.室温下纯水的有关数据(1)c(H+)=c(OH-)=__________。(2)KW=__________=________。(3)pH=____。3.KW的影响因素KW只与温度有关,温度升高,KW______。特别提示:水的离子积常数 KW=c(H+)·c(OH-),其实质是水溶液中的 H+和 OH-浓度的乘积,不一定是水电离出的 H+和 OH-浓度的乘积,所以与其说 KW是水的离子积常数,不如说是水溶液中的 H+和 OH-的离子积常数。二、溶液的酸碱性与 pH1.溶液的酸碱性溶液的酸碱性取决于溶液中________和________的相对大小。c(H+)、c(OH-)的关系室温/25 ℃数值pH中性溶液c(H+)__c(OH-)c(H+)=c(OH-)=______________7酸性溶液c(H+)__c(OH-)c(H+)__1×10-7 mol·L-1____7碱性溶液c(H+)__c(OH-)c(H+)__1×10-7 mol·L-1____72.pH(1)定义式:pH=__________。(2)意义表示溶液酸碱性的强弱,pH 越小,酸性______。(3)pH 试纸的使用① 方法:____________________________________________________________,试纸变色后,与标准比色卡对比即可确定溶液的 pH。② 注意:a.pH 试纸使用前不能用蒸馏水润湿,否则待测液因被稀释可能产生误差;b.用广泛 pH 试纸读出的 pH 只能是整数。即时训练 1 下列说法中正确的是______。① 某溶液的 pH=7,该溶液一定为中性溶液② 某溶液的 c(H+)>c(OH-),该溶液一定为酸性溶液③ 任何水溶液中均存在 H+和 OH-,且水电离出的 H+和 OH-相等④ 如果溶液中 c(H+)≠c(OH-),该溶液一定为酸性或碱性溶液特别提示:溶液酸碱性的判断与溶液的 pH 是否等于 7 没有直接的关系,而应比较溶液中 c(H+)与 c(OH-)的大小。pH 是否等于 7 只适用于室温下的溶液,而用 c(H+)与c(OH-)的大小判断酸碱性,不受条件限制适用于任何温度下的溶液。三、酸碱中和滴定1.实验用品(1)试剂:__________、__________、__________、蒸馏水。(2)仪器:______滴定管(如图 A)、______滴定管(如图 B)、滴定管夹、铁架台、烧杯、________。2.实验操作(以标准盐酸滴定待测 NaOH 溶液...