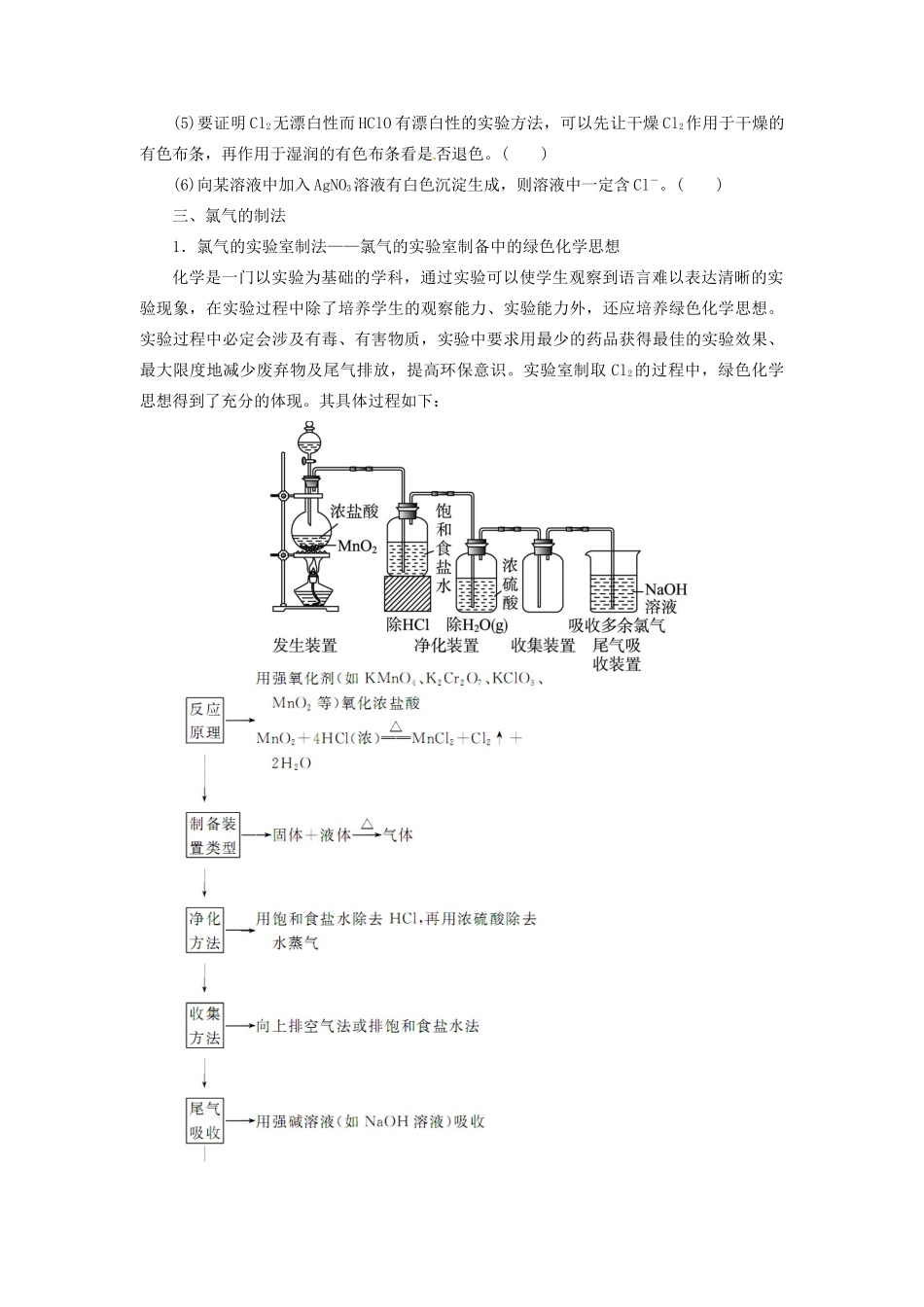
第二节 研究物质性质的基本方法和程序——以氯为例考纲点击1.了解氯单质及重要化合物的主要性质及应用。2.了解氯的单质及其化合物对环境质量的影响。掌握氯气的实验室制法。3.掌握氯水的成分,氯的重要化合物 HCl、HClO、次氯酸盐的重要性质及应用。一、氯气的性质1.氯气的物理性质通常情况下,氯气是________色__________气味的气体。密度比空气大,有毒,易液化,能溶于水,通常 1 体积水约溶解____体积氯气,其水溶液称为氯水。但在饱和氯化钠溶液中的溶解度很小,所以可用______________法收集氯气。特别提示:实验室里闻有毒气体及未知气体气味的方法是用手在瓶口轻轻扇动,仅使极少量气体飘进鼻孔。(如图所示)闻气体时的正确操作2.氯气的化学性质(写出反应方程式和部分反应现象,指出 Cl2在反应中表现氧化性还是还原性)特别提示:燃烧的本质是氧化还原反应,概念是剧烈的发热发光的氧化还原反应。燃烧不一定有氧气参加反应(如 H2在 Cl2中燃烧生成 HCl)。3.应用及原理(1)制盐酸:利用 H2在 Cl2中燃烧生成 HCl,然后溶于水制盐酸。(2)制漂白液:利用 Cl2与________溶液反应制备,其有效成分为________。(3)制漂白粉:利用 Cl2与________乳浊液反应制备,其有效成分为________。特别提示:氯气通入石蕊溶液中的现象是:先变红后退色;常见的有颜色的气体有:NO2红棕色、Cl2黄绿色。即时训练 1 下列氯化物中,既能由金属和氯气直接反应得到,又能由金属和盐酸反应制得的是( )。A.FeCl2 B.AlCl3C.FeCl3 D.CuCl2二、氯的重要化合物1.次氯酸(HClO)(1)不稳定性:化学方程式为______________________。氯水要现用现配,保存在________试剂瓶中。(2)弱酸性:比碳酸酸性______,电离方程式为__________________。(3)强氧化性:使有色布条退色,能杀菌,用作________、__________。2.Ca(ClO)2的主要化学性质(1)Ca(ClO)2是____________的有效成分,它的稳定性比 HClO______。(2)水解显______性,其水解离子方程式:______________________________。(3)与酸反应生成________,作为漂白或消毒剂的原理可用化学方程式表示为__________________________。3.漂白粉(1)漂白粉成分:______________________,有效成分:________。(2)制取原理:____________________________。(3)化学性质:水解显______性,具有强________性。(4)失效原因:________________________________。必须密封保存。(5)漂白原理:与酸性物质反应生成了...