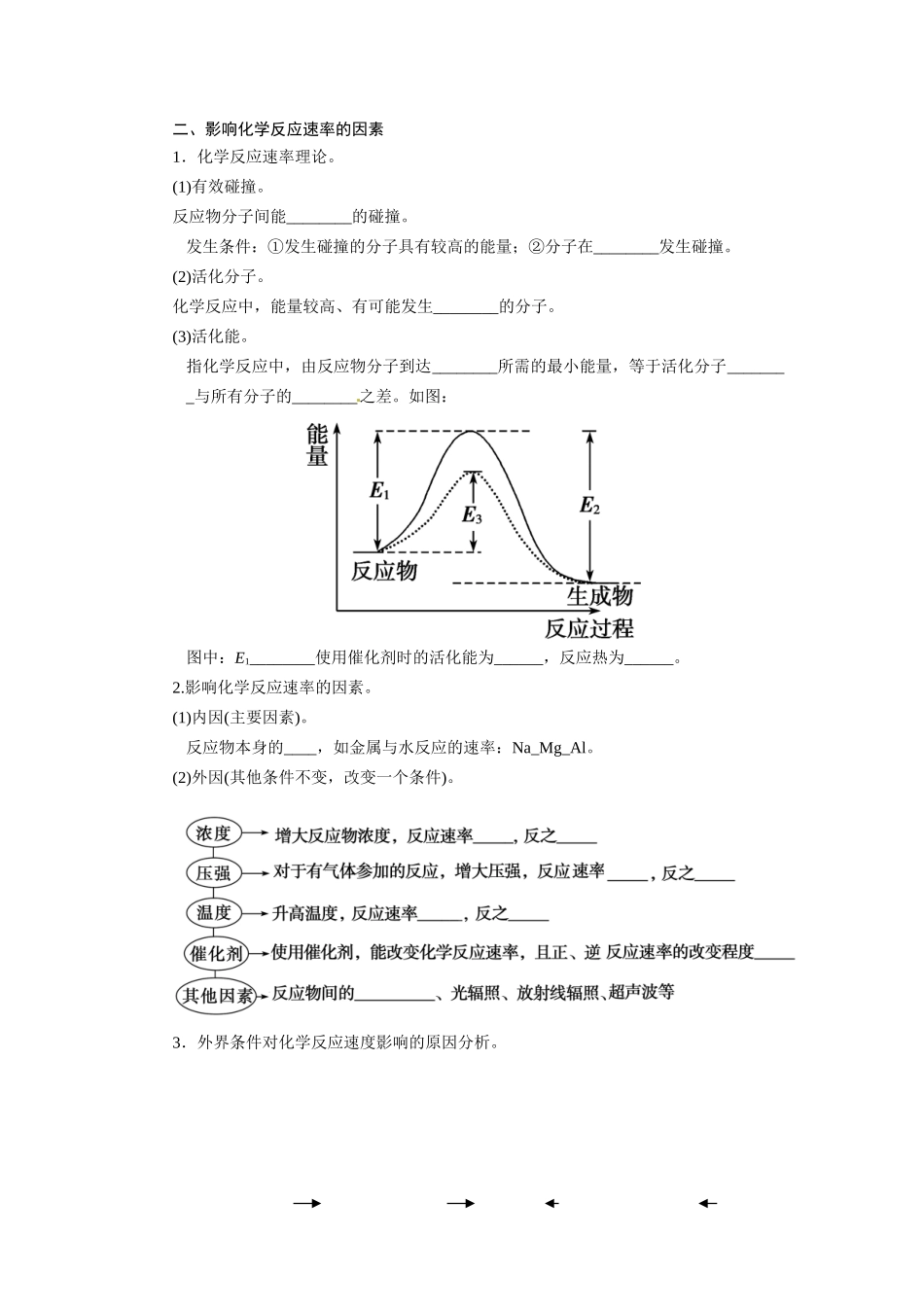
第一节化学反应速率 梳理基础一、化学反应速率1.概念。用来衡量化学反应进行____________程度的物理量。2.表示方法。通常用单位时间内__________或__________来表示。符号为______,单位为________或 mol/(L·s)或 mol/(L·h)。3.表达式。v=________。4.同一反应中用不同物质表示的反应速率的关系。对于反应 aA+bBcC+dD 在同一时间段内用不同物质表示的化学反应速率的关系为:v(A) : v(B) : v(C) : v(D)=____________,数值有可能______同,但表示的意义______。1.了解化学反应速率的概念,反应速率的定量表示方法。2.了解催化剂在生产、生活和科学研究领域中的重大作用。3.理解浓度、温度、压强、催化剂影响化学反应速率的一般规律。4.了解化学反应速率的调控在生活、生产和科学研究领域中的重要作用。二、影响化学反应速率的因素1.化学反应速率理论。(1)有效碰撞。反应物分子间能________的碰撞。发生条件:①发生碰撞的分子具有较高的能量;②分子在________发生碰撞。(2)活化分子。化学反应中,能量较高、有可能发生________的分子。(3)活化能。指化学反应中,由反应物分子到达________所需的最小能量,等于活化分子________与所有分子的________之差。如图:图中:E1________使用催化剂时的活化能为______,反应热为______。2.影响化学反应速率的因素。(1)内因(主要因素)。反应物本身的____,如金属与水反应的速率:Na_Mg_Al。(2)外因(其他条件不变,改变一个条件)。3.外界条件对化学反应速度影响的原因分析。 答案:梳理基础一、1.快慢2.反应物浓度的减小 生成物浓度的增加 v mol/(L·min)3.4.a :b :c :d 不 相同二、1.(1)发生反应 一定的方向上 (2)有效碰撞 (3)活化分子 平均能量 平均能量 反应的活化能 E3 E1-E22.(1)性质 > > (2)增大 减小 增大 减小 增大 减小 相同 接触面积 判断正误正确的打“√”,错误的打“×”。1.对于反应 2H2O2===2H2O+O2↑,加入 MnO2或升高温度都能加快 O2的生成速率( )2.常温下 Na 与足量 O2反应生成 Na2O,随温度升高生成 Na2O 的速率逐渐加快( )3.N2(g)+3H2(g)2NH3 ΔH < 0,其他条件不变时升高温度,反应速率 v(H2)和H2的平衡转化率均增大( )4.SO2(g)+2CO(g) 2CO2(g)+S(l) ΔH < 0,若反应在恒容的密闭容器中进行,平衡时,其他条件不变,分离出硫,正反应速率加快( )5.在一个不导热的密闭反应器中,只...