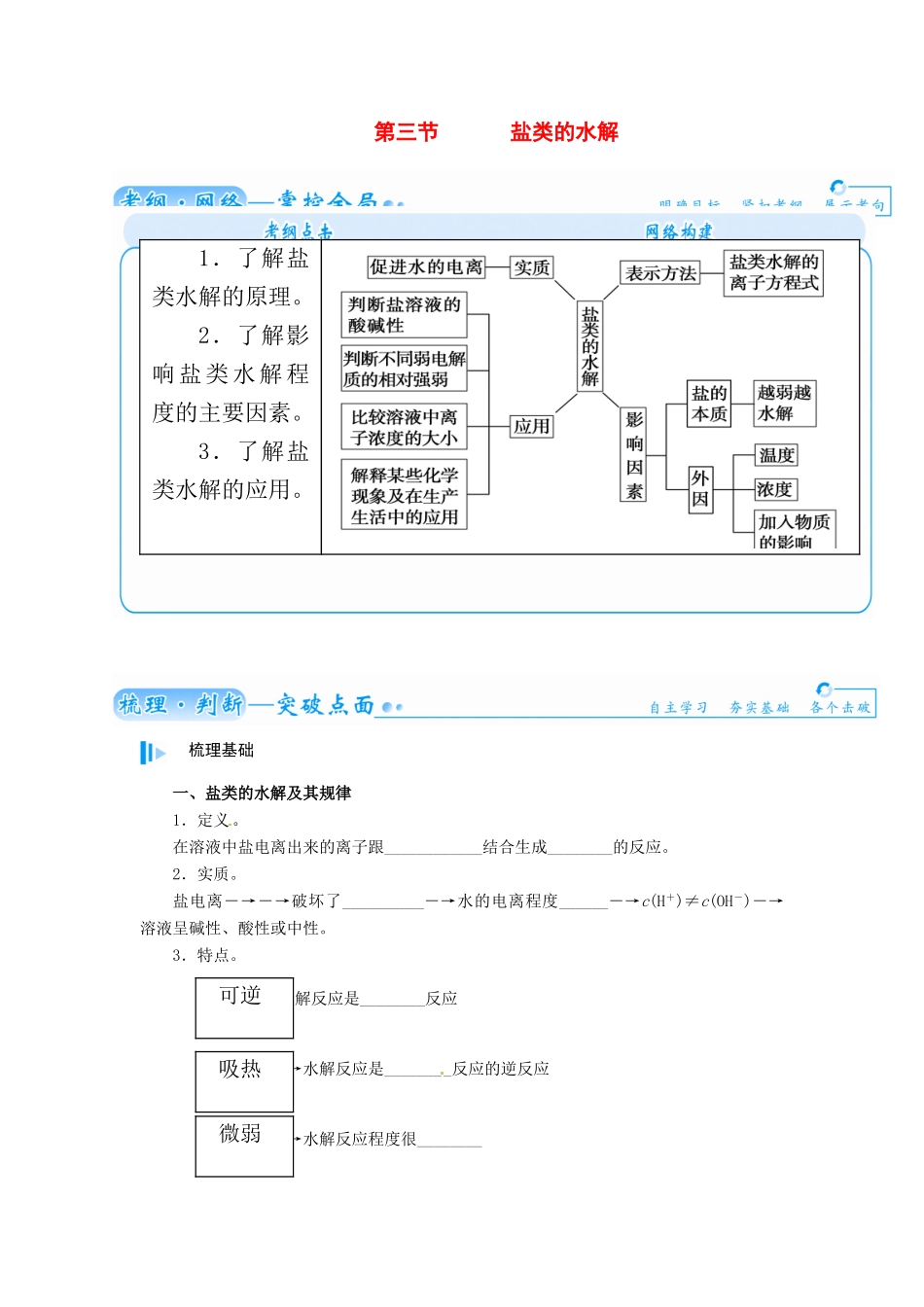
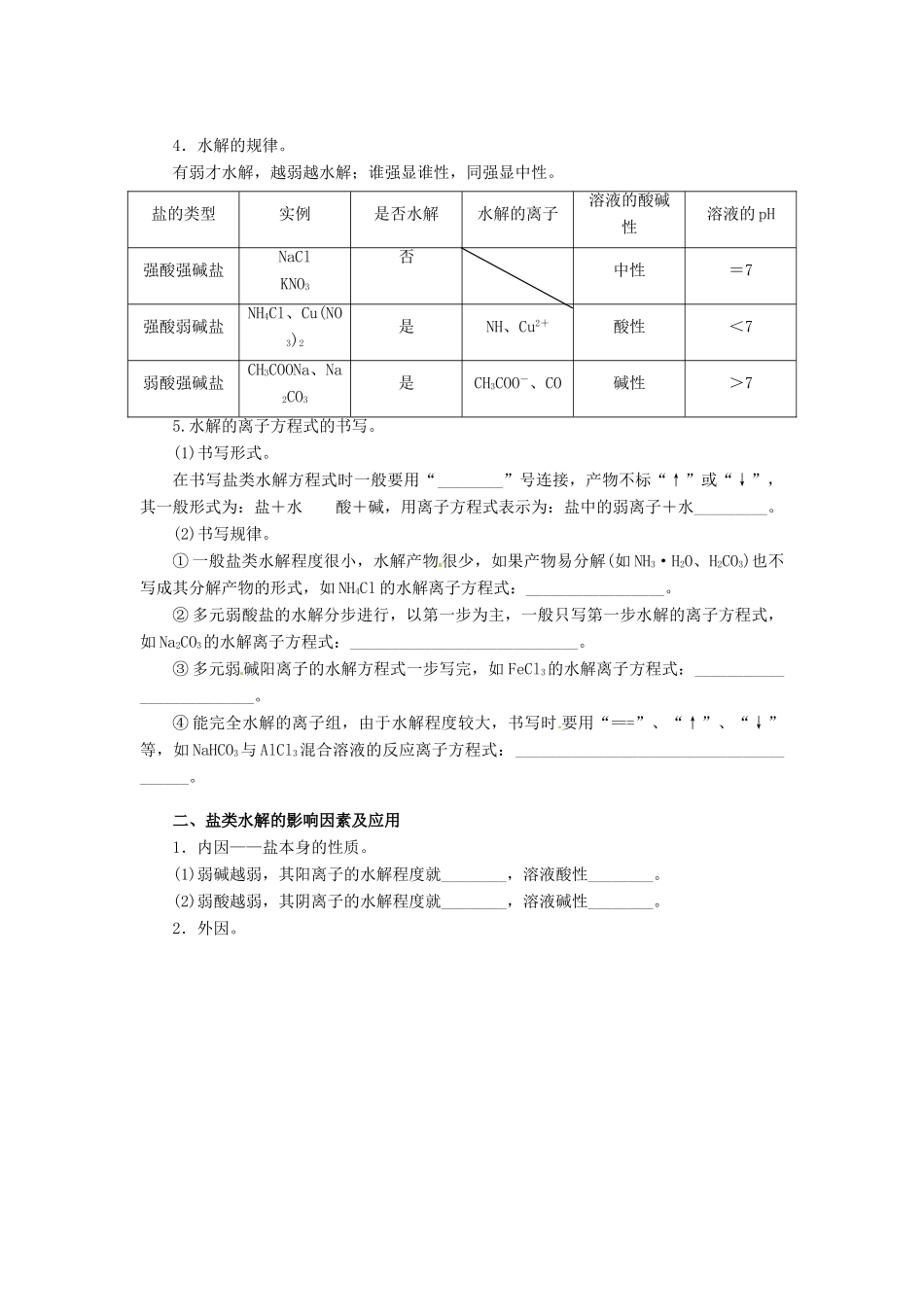
第三节盐类的水解梳理基础一、盐类的水解及其规律1.定义。在溶液中盐电离出来的离子跟____________结合生成________的反应。2.实质。盐电离―→―→破坏了__________―→水的电离程度______―→c(H+)≠c(OH-)―→溶液呈碱性、酸性或中性。3.特点。―→水解反应是________反应―→水解反应是________反应的逆反应―→水解反应程度很________1.了解盐类水解的原理。2.了解影响 盐 类 水 解 程度的主要因素。3.了解盐类水解的应用。可逆吸热微弱4.水解的规律。有弱才水解,越弱越水解;谁强显谁性,同强显中性。盐的类型实例是否水解水解的离子溶液的酸碱性溶液的 pH强酸强碱盐NaClKNO3否中性=7强酸弱碱盐NH4Cl、Cu(NO3)2是NH、Cu2+酸性<7弱酸强碱盐CH3COONa、Na2CO3是CH3COO-、CO碱性>75.水解的离子方程式的书写。(1)书写形式。在书写盐类水解方程式时一般要用“________”号连接,产物不标“↑”或“↓”,其一般形式为:盐+水酸+碱,用离子方程式表示为:盐中的弱离子+水_________。(2)书写规律。① 一般盐类水解程度很小,水解产物 很少,如果产物易分解(如 NH3·H2O、H2CO3)也不写成其分解产物的形式,如 NH4Cl 的水解离子方程式:_________________。② 多元弱酸盐的水解分步进行,以第一步为主,一般只写第一步水解的离子方程式,如 Na2CO3的水解离子方程式:____________________________。③ 多元弱碱阳离子的水解方程式一步写完,如 FeCl3的水解离子方程式:_________________________。④ 能完全水解的离子组,由于水解程度较大,书写时 要用“===”、“↑”、“↓”等,如 NaHCO3与 AlCl3混合溶液的反应离子方程式:_______________________________________。二、盐类水解的影响因素及应用1.内因——盐本身的性质。(1)弱碱越弱,其阳离子的水解程度就________,溶液酸性________。(2)弱酸越弱,其阴离子的水解程度就________,溶液碱性________。2.外因。3.应用。(1)用离子方程式表示下列应用的反应原理。① 制备 Fe(OH)3胶体:______________________________。② 明矾净水:_____________________________________。(2)配制盐溶液。配制 SnCl2溶液时,为抑制 Sn2+水解,应向其中加入少量的________。答案:梳理基础一、1.水电离出的 H+或 OH- 弱电解质2.H+ OH- 水的电离平衡 增大3.可逆 中和 微弱5 . (1) 弱 酸 ( 碱 ) + OH - (H + ) (2)①NH +...