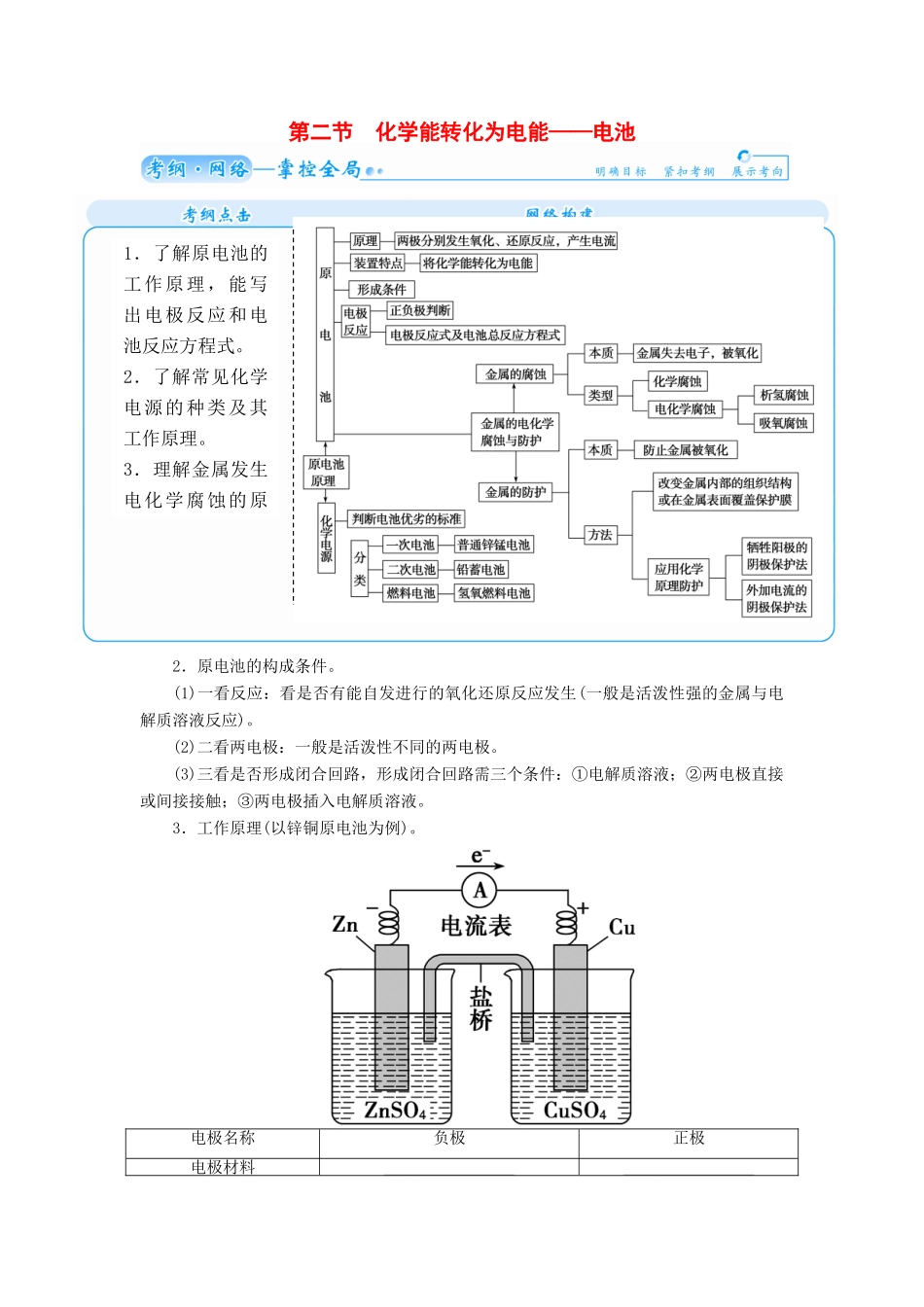
第二节 化学能转化为电能——电池梳理基础一、原电池1.定义。原电池是把________转化为________的装置。答案:1.化学能 电能2.原电池的构成条件。(1)一看反应:看是否有能自发进行的氧化还原反应发生(一般是活泼性强的金属与电解质溶液反应)。(2)二看两电极:一般是活泼性不同的两电极。(3)三看是否形成闭合回路,形成闭合回路需三个条件:①电解质溶液;②两电极直接或间接接触;③两电极插入电解质溶液。3.工作原理(以锌铜原电池为例)。电极名称负极正极电极材料________________________________1.了解原电池的工作原理,能写出电极反应和电池反应方程式。2.了解常见化学电源的种类及其工作原理。3.理解金属发生电化学腐蚀的原因,金属腐蚀的电极反应________________________________反应类型________________________________电子流向由________沿导线流向________盐桥中离子移向盐桥含饱和 KCl 溶液,______移向正极,______移向负极答案:3.锌片 铜片 Zn-2e-===Zn2+ Cu2++2e-===Cu 氧化反应 还原反应 Zn Cu K+ Cl-二、几种常见的化学电源电池负极反应正极反应总反应式一次电池(锌锰干电池)酸性锌锰干电池___________2NH+2e-===2NH3↑+H2↑碱性锌锰干电池Zn+2OH--2e-===Zn(OH)22MnO2+2H2O+2e-=== 2MnO(OH)+2OH-__________________________________二次电池(铅蓄电池)____________________________________________________________Pb(s)+PbO2(s)+2H2SO4(aq)=== 2PbSO4(s)+2H2O(l)燃料电池(氢氧燃料电池)酸性氢氧燃料电池____________________________________________________________2H2+O2===2H2O碱性氢氧燃料电池____________________________________________________________2H2+O2===2H2O答案:Zn-2e -===Zn2 + Zn+2MnO2+2H2O===2MnO(OH)+Zn(OH)2 Pb+SO-2e -===PbSO4 PbO2+4H++SO +2e-===PbSO4+2H2O 2H2-4e-===4H+O2+4e-+4H+===2H2O 2H2-4e-+4OH-===4H2OO2+4e-+2H2O===4OH-三、金属的腐蚀与防护1.化学腐蚀与电化学腐蚀。化学腐蚀电化学腐蚀定义金属跟接触到的物质(如 O2、Cl2、SO2等)________发生________反应而引起的腐蚀不纯金属与电解质溶液接触时,发生______反应,________的金属失电子而被氧化本质______电流产生________电流产生现象金属被________(氧化)________金属被腐蚀(氧化)实例金属与 Cl2、O2等物质直接发生化学反钢铁在潮...