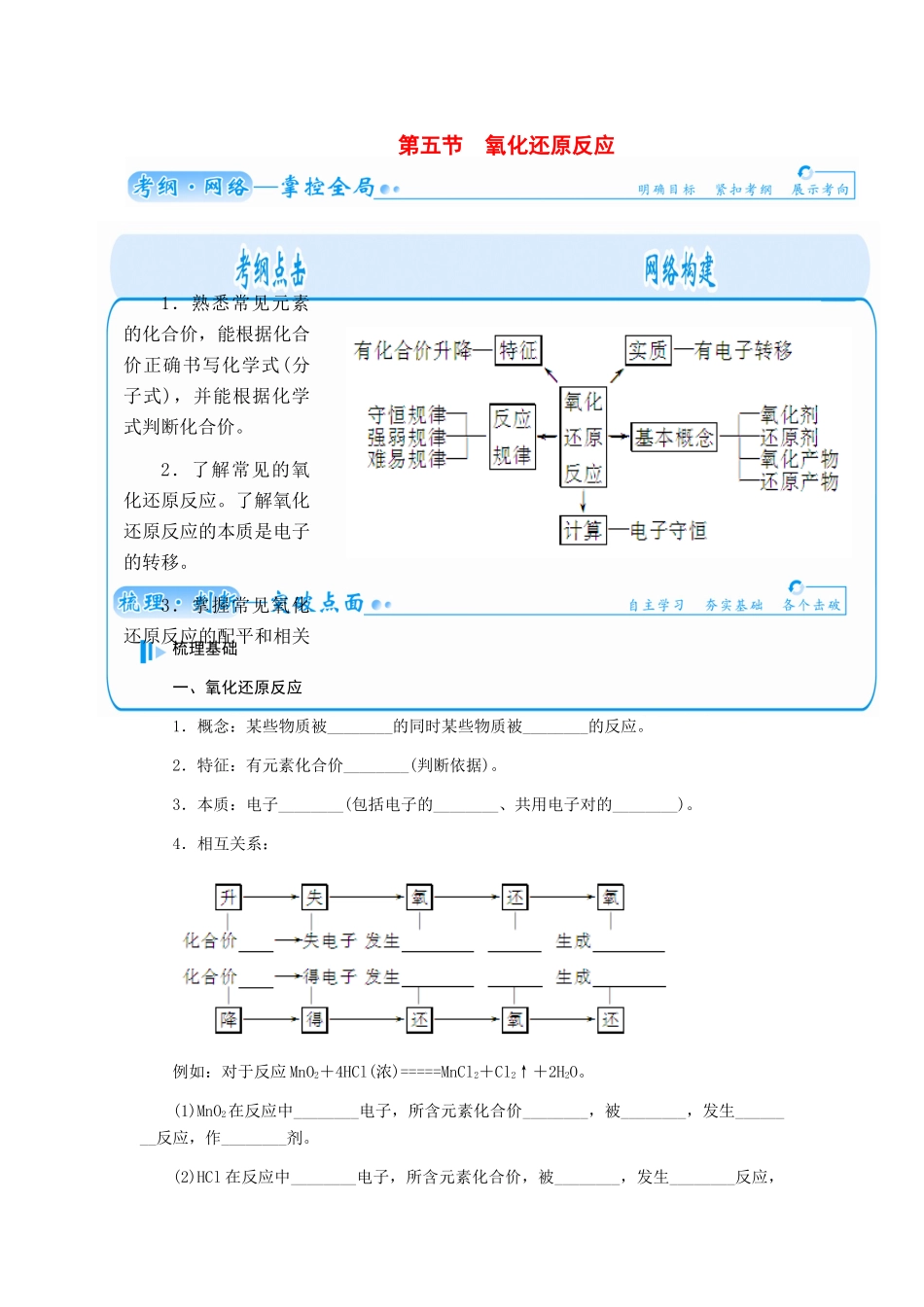
第五节 氧化还原反应 梳理基础一、氧化还原反应1.概念:某些物质被________的同时某些物质被________的反应。2.特征:有元素化合价________(判断依据)。3.本质:电子________(包括电子的________、共用电子对的________)。4.相互关系:例如:对于反应 MnO2+4HCl(浓)=====MnCl2+Cl2↑+2H2O。(1)MnO2在反应中________电子,所含元素化合价________,被________,发生________反应,作________剂。(2)HCl 在反应中________电子,所含元素化合价,被________,发生________反应,1.熟悉常见元素的化合价,能根据化合价正确书写化学式(分子式),并能根据化学式判断化合价。2.了解常见的氧化还原反应。了解氧化还原反应的本质是电子的转移。3.掌握常见氧化还原反应的配平和相关计算。作________剂。(3)若有 1 mol MnO2完全反应,则参加反应的 HCl 为________mol,其中有____ mol 被氧化。5.氧化还原反应与四种基本反应类型的关系。6.氧化还原反应中电子转移的表示方法。(1)双线桥法:表示元素原子在化学反应前后电子得失的情况和数目。线桥的箭尾必须指在反应物中发生变化的元素上,箭头指向生成物中的该元素上。3Cu+8HNO3(稀)===3C 失去 3×2e-u(NO3)2+2N 得到 2×3e-O↑+4H2O 还原剂+氧化剂===氧失 ne-(升 n 价)化产物+还得 ne-(降 n 价)原产物注意事项:①箭头必须由反应物指向生成物,且两端对准同种元素。② 箭头方向不代表电子转移方向,仅表示电子转移前后的变化。(2)单线桥法:表示反应物中元素原子发生电子转移的方向和数目 。线桥的箭尾指向失电子元素的原子,箭头指向得电子元素的原子,电子数目是方程式中总的转移电子的数目,电子数前面不用标明“得”、“失”。3Cu+8HN6e-O3(稀)===3Cu(NO3)2+2NO↑+4H2O 还原剂+氧化 ne-剂===氧化产物+还原产物注意事项:①箭头必须由还原剂中失电子的元素指向氧化剂中得电子的元素。② 箭头方向表示电子转移的方向。③ 在“桥”上标明转移的是电子总数。二、氧化剂和还原剂1.常见氧化剂。 物质类型举例对应还原产物活泼的非金属单质X2(卤素)________O2________元素处于高化合价时的化合物或离子氧化物MnO2________含氧酸浓硫酸________HNO3________盐KMnO4________Fe3+________过氧化物Na2O2、H 2O2H2O 2.常见还原剂。物质类型举例对应氧化产物活泼的金属单质Zn________某些非金属单质H2________C________元素处于低化合价时的化合物或离子...