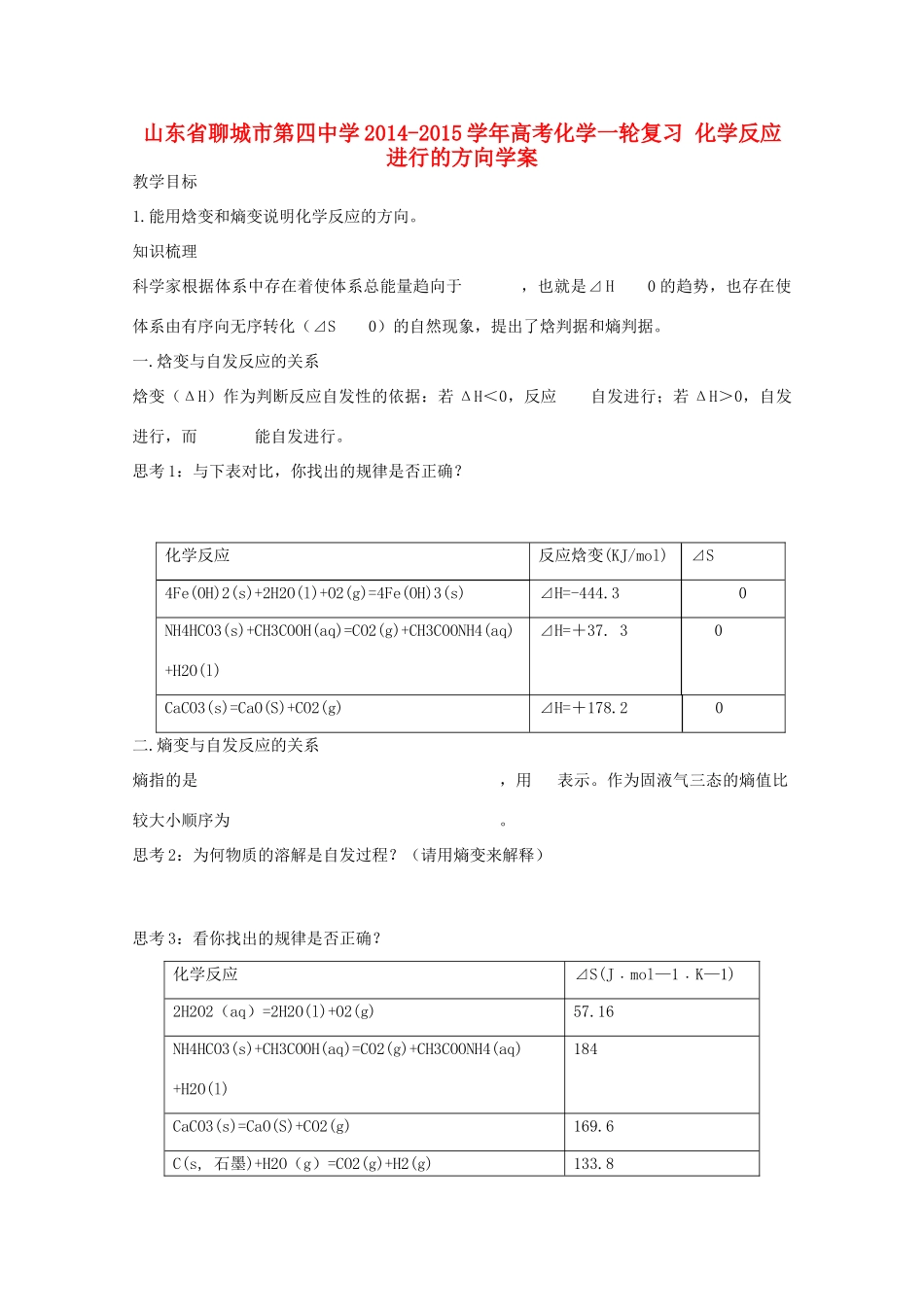
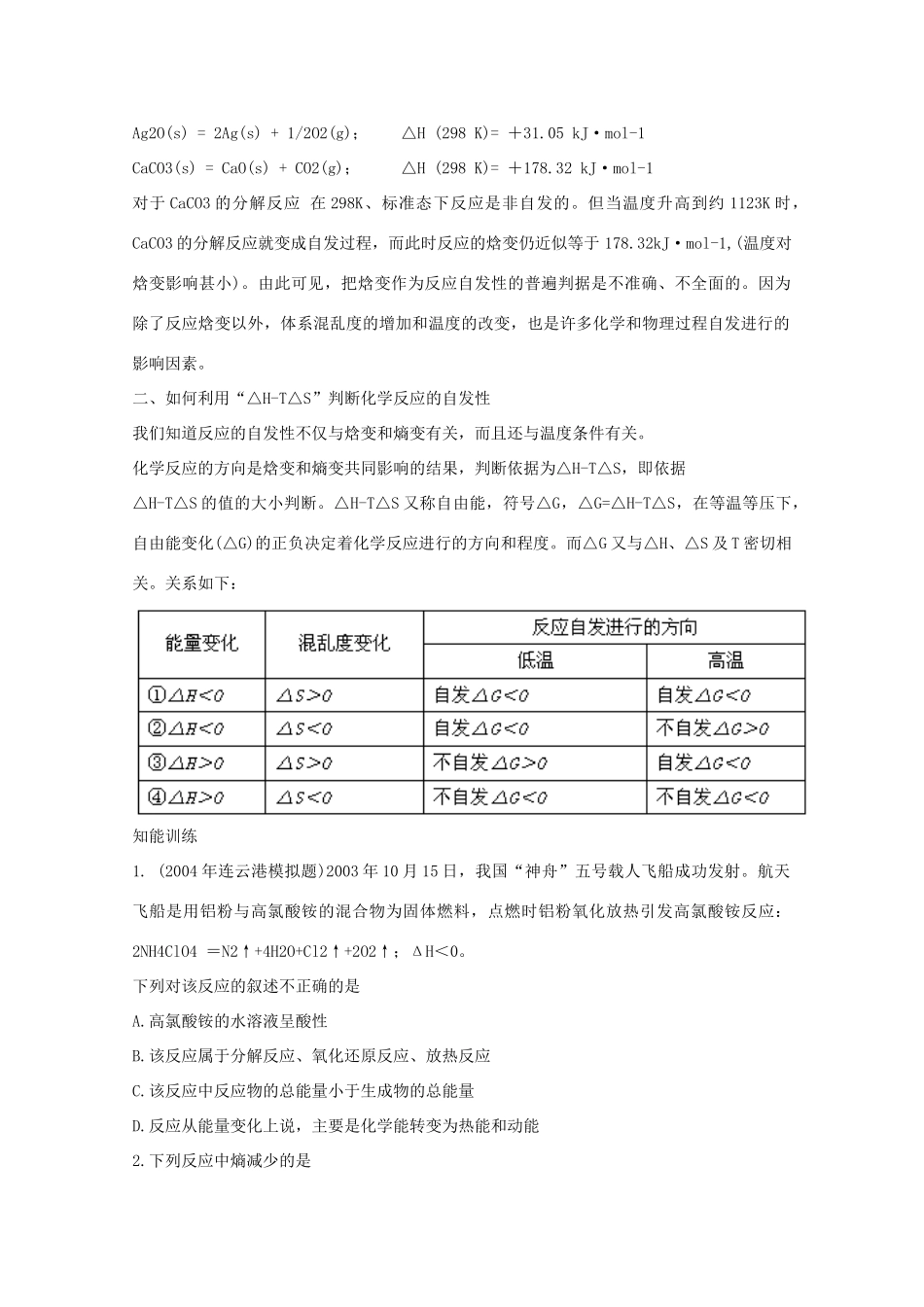
山东省聊城市第四中学 2014-2015 学年高考化学一轮复习 化学反应进行的方向学案 教学目标 1.能用焓变和熵变说明化学反应的方向。知识梳理科学家根据体系中存在着使体系总能量趋向于 ,也就是⊿ H 0 的趋势,也存在使体系由有序向无序转化(⊿S 0)的自然现象,提出了焓判据和熵判据。 一.焓变与自发反应的关系焓变(ΔH)作为判断反应自发性的依据:若 ΔH<0,反应 自发进行;若 ΔH>0,自发进行,而 能自发进行。思考 1:与下表对比,你找出的规律是否正确? 化学反应反应焓变(KJ/mol)⊿S4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s)⊿H=-444.3 0NH4HCO3(s)+CH3COOH(aq)=CO2(g)+CH3COONH4(aq)+H2O(l)⊿H=+37. 3 0CaCO3(s)=CaO(S)+CO2(g)⊿H=+178.2 0二.熵变与自发反应的关系熵指的是 ,用 表示。作为固液气三态的熵值比较大小顺序为 。思考 2:为何物质的溶解是自发过程?(请用熵变来解释) 思考 3:看你找出的规律是否正确?化学反应⊿S(J﹒mol—1﹒K—1)2H2O2(aq)=2H2O(l)+O2(g)57.16NH4HCO3(s)+CH3COOH(aq)=CO2(g)+CH3COONH4(aq)+H2O(l)184CaCO3(s)=CaO(S)+CO2(g)169.6C(s, 石墨)+H2O(g)=CO2(g)+H2(g)133.82Al(s)+Fe2O3(s)=Al2O3(s)+2Fe(s)-39.35结论: 三.自发反应的判断依据焓变(焓判据)只能判断 ,熵变(熵判据)只能判断 。思考 4:下表列入了反应的自发性的一些情况。反应热 熵值所属反应的自发性反应举例放热放热吸热吸热增大减小增大减小任何温度都自发进行较低温时自发进行高温时自发进行任何温度都不能自发进行2H2O2(l)=2H2O(l)+O2(g)NH3(g)+HCl(g)=NH4Cl(s)CaCO3(s)=CaO(s)+CO2(g)结论:二者的复合判据才是自发反应的判断标准。二者对反应方向的影响存在着关系:⊿H—T⊿S<0 正反应自发进行;⊿H—T⊿S>0 逆反应自发进行。疑难点拨但是,实践表明:有些吸热过程(△H >0)亦能自发进行。例如,水的蒸发,NH4Cl 溶于水以及 Ag2O 的分解等都是吸热过程,但在 298K、标准态下均能自发进行: NH4Cl(s) = NH4+(aq) + Cl-(aq); △H (298 K)= +14.7 kJ·mol-1Ag2O(s) = 2Ag(s) + 1/2O2(g); △H (298 K)= +31.05 kJ·mol-1 CaCO3(s) = CaO(s) + CO2(g); △H (298 K)= +178.32 kJ·mol-1对于 CaCO3 的分解反应 在 298K、标准态下反应是非自发的。但当温度升高到约 1123K 时,CaCO3 的分解反应就变成自发过程,而此时反应的焓变仍...