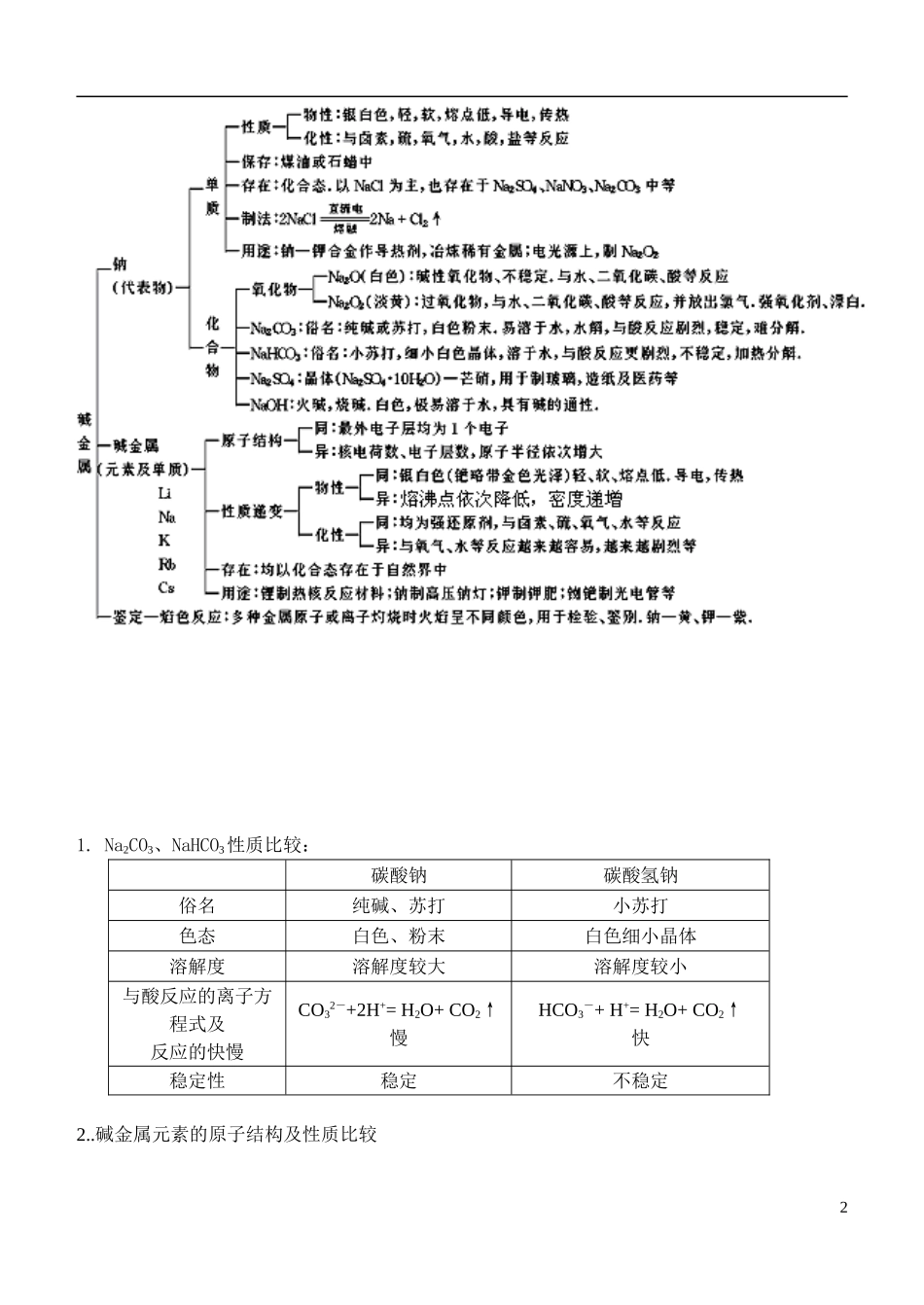
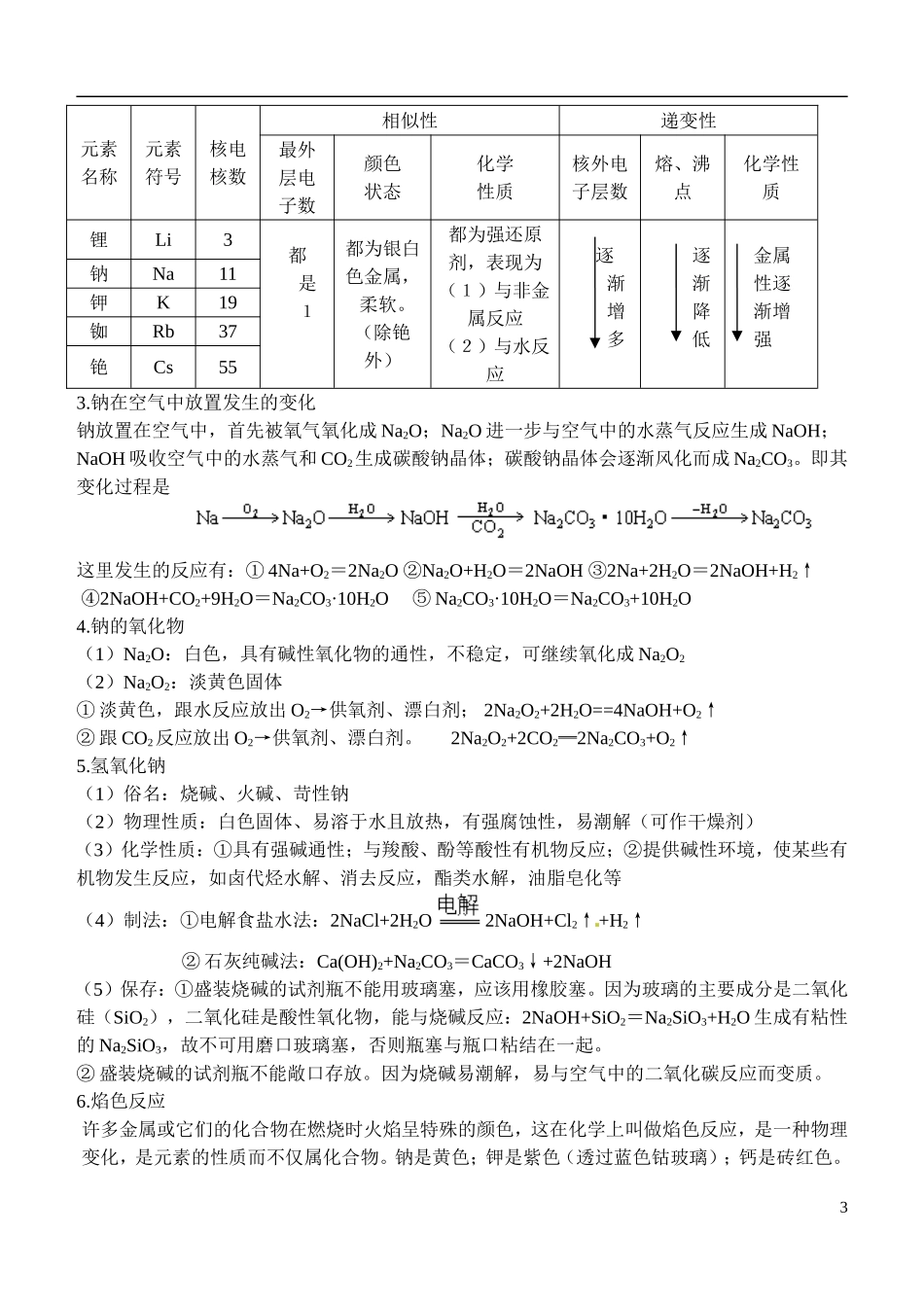
山东省聊城市第四中学 2014 届高三化学总复习(模块三)专题一 金属及其化合物(基本内容)教学案一.金属的晶体结构和性质金 属活动顺序K Ca NaMg AlZn Fe Sn Pb(H)Cu Hg AgPt Au还原性————————→(依次 )离子氧化性————————→(依次 ) (Fe 的离子为 Fe2+)与 O2反应条件常温易氧化常温能反应常温不易(缓慢)氧化加热被氧化不反应与 H2O 反应遇水就放氢加热或与水蒸气反应不反应与酸置换反应氢前置换氢不能置换出 H2与盐的反应先与 H2O 反应前金换后金冶炼方法熔融电解热还原剂置换、热分解法富集二 碱金属11. Na2CO3、NaHCO3性质比较:碳酸钠碳酸氢钠俗名纯碱、苏打小苏打色态白色、粉末白色细小晶体溶解度溶解度较大溶解度较小与酸反应的离子方程式及反应的快慢CO32-+2H+= H2O+ CO2↑慢HCO3-+ H+= H2O+ CO2↑快稳定性稳定不稳定2..碱金属元素的原子结构及性质比较2元素名称元素符号核电核数相似性递变性最外层电子数颜色状态化学性质核外电子层数熔、沸点化学性质锂Li3都是1都为银白色金属,柔软。(除铯外)都为强还原剂,表现为(1)与非金属反应(2)与水反应 逐渐增多逐渐降低金属性逐渐增强钠Na11钾K19铷Rb37铯Cs553.钠在空气中放置发生的变化钠放置在空气中,首先被氧气氧化成 Na2O;Na2O 进一步与空气中的水蒸气反应生成 NaOH;NaOH 吸收空气中的水蒸气和 CO2生成碳酸钠晶体;碳酸钠晶体会逐渐风化而成 Na2CO3。即其变化过程是 这里发生的反应有:① 4Na+O2=2Na2O ②Na2O+H2O=2NaOH ③2Na+2H2O=2NaOH+H2↑ ④2NaOH+CO2+9H2O=Na2CO3·10H2O ⑤ Na2CO3·10H2O=Na2CO3+10H2O4.钠的氧化物(1)Na2O:白色,具有碱性氧化物的通性,不稳定,可继续氧化成 Na2O2(2)Na2O2:淡黄色固体① 淡黄色,跟水反应放出 O2→供氧剂、漂白剂; 2Na2O2+2H2O==4NaOH+O2↑② 跟 CO2反应放出 O2→供氧剂、漂白剂。 2Na2O2+2CO2═2Na2CO3+O2↑5.氢氧化钠(1)俗名:烧碱、火碱、苛性钠(2)物理性质:白色固体、易溶于水且放热,有强腐蚀性,易潮解(可作干燥剂)(3)化学性质:①具有强碱通性;与羧酸、酚等酸性有机物反应;②提供碱性环境,使某些有机物发生反应,如卤代烃水解、消去反应,酯类水解,油脂皂化等(4)制法:①电解食盐水法:2NaCl+2H2O 2NaOH+Cl2↑+H2↑② 石灰纯碱法:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH(5)保存:①盛装烧碱的试剂瓶不能用玻璃塞,应...