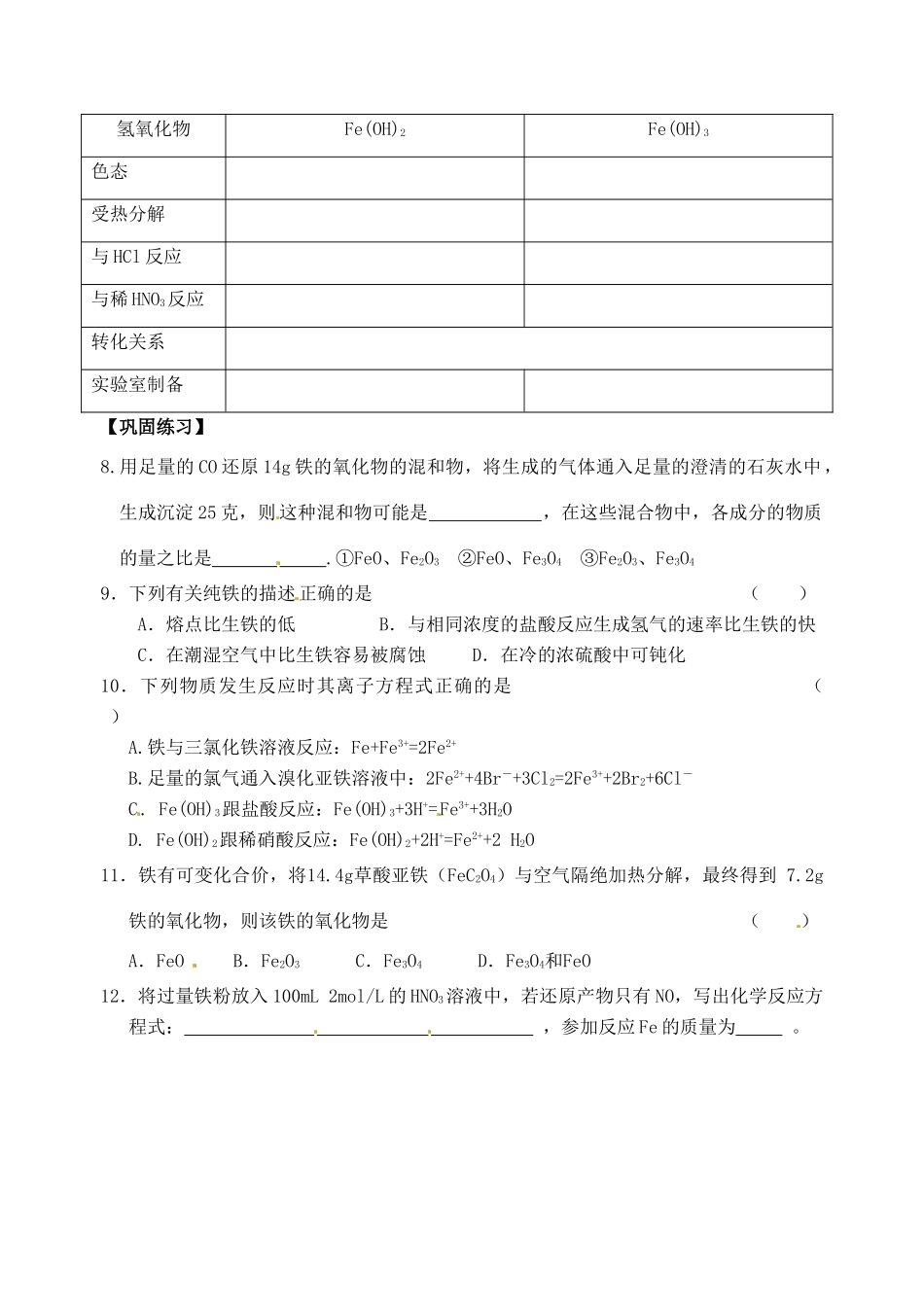
江苏省响水中学 2014 届高三化学一轮复习学案:第 11 课时 铁及其化合物【考纲要求】1、掌握铁、铁的氧化物和铁的氢氧化物的性质2、掌握氢氧化亚铁的制备【考点分析】 1、铁的结构:位于周期表中第_____周期,_____族,核电荷数____,外围电子排布式_________,反应可失去_____个或_____个电子,显_____价和_____价。2、物性、存在:铁具有金属的通性,而且能被_________吸引。铁在自然界主要以_________态存在,游离态的铁只能从________获得。3、化学性质:(写出相应的化学方程式) (1) Fe + O2 点燃 (2) Fe + H2 O(气) 高温 (3) Fe + Cl2 — (4) Fe + I2 —(5) Fe(OH)2 + O2+ H2O — (6) Fe+ HNO3 (稀、过量) — (7)Fe+FeCl3 —4、2.8g 铁投入 160mL1mol/L 稀硝酸中,充分反应放出 NO 气体.求:① 反应结束后溶液中各阳离子浓度 ②反应中 HNO3共得到电子的物质的量5、铁的氧化物氧化物化学式FeOFe2O3Fe3O4俗称色态铁的价态与盐酸反应与 CO 反应与铝反应6、铁的氢氧化物氢氧化物Fe(OH)2Fe(OH)3色态受热分解与 HCl 反应与稀 HNO3反应转化关系实验室制备【巩固练习】8.用足量的 CO 还原 14g 铁的氧化物的混和物,将生成的气体通入足量的澄清的石灰水中,生成沉淀 25 克,则 这种混和物可能是 ,在这些混合物中,各成分的物质的量之比是 .①FeO、Fe2O3 ②FeO、Fe3O4 ③Fe2O3、Fe3O49.下列有关纯铁的描述正确的是 ( )A.熔点比生铁的低B.与相同浓度的盐酸反应生成氢气的速率比生铁的快C.在潮湿空气中比生铁容易被腐蚀 D.在冷的浓硫酸中可钝化10.下列物质发生反应时其离子方程式正确的是 ( ) A.铁与三氯化铁溶液反应:Fe+Fe3+=2Fe2+B.足量的氯气通入溴化亚铁溶液中:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-C. Fe(OH)3跟盐酸反应:Fe(OH)3+3H+=Fe3++3H2OD. Fe(OH)2跟稀硝酸反应:Fe(OH)2+2H+=Fe2++2 H2O11.铁有可变化合价,将14.4g草酸亚铁(FeC2O4)与空气隔绝加热分解,最终得到 7.2g铁的氧化物,则该铁的氧化物是 ( )A.FeO B.Fe2O3 C.Fe3O4 D.Fe3O4和FeO12.将过量铁粉放入 100mL 2mol/L 的 HNO3溶液中,若还原产物只有 NO,写出化学反应方程式: ,参加反应 Fe 的质量为 。