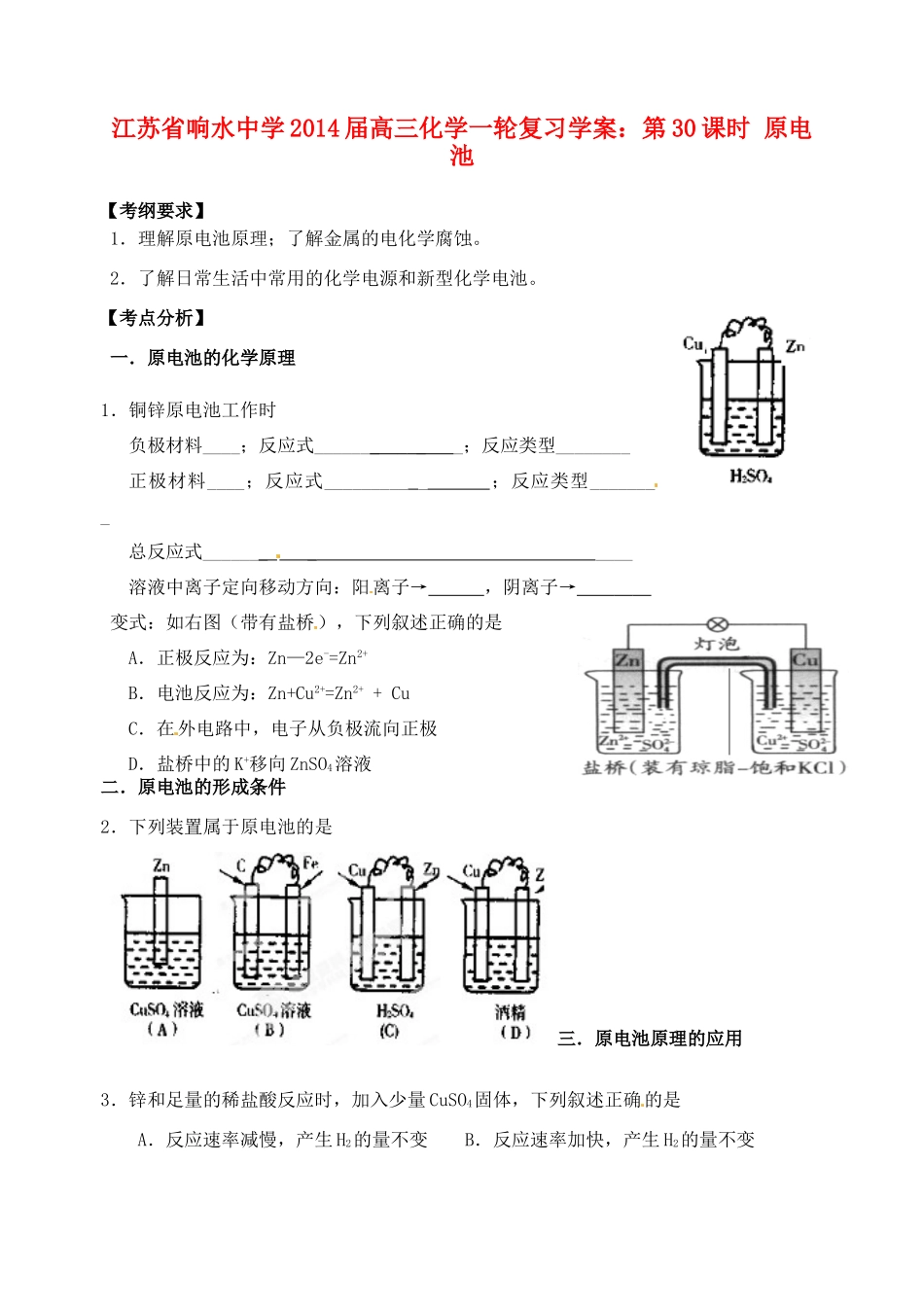
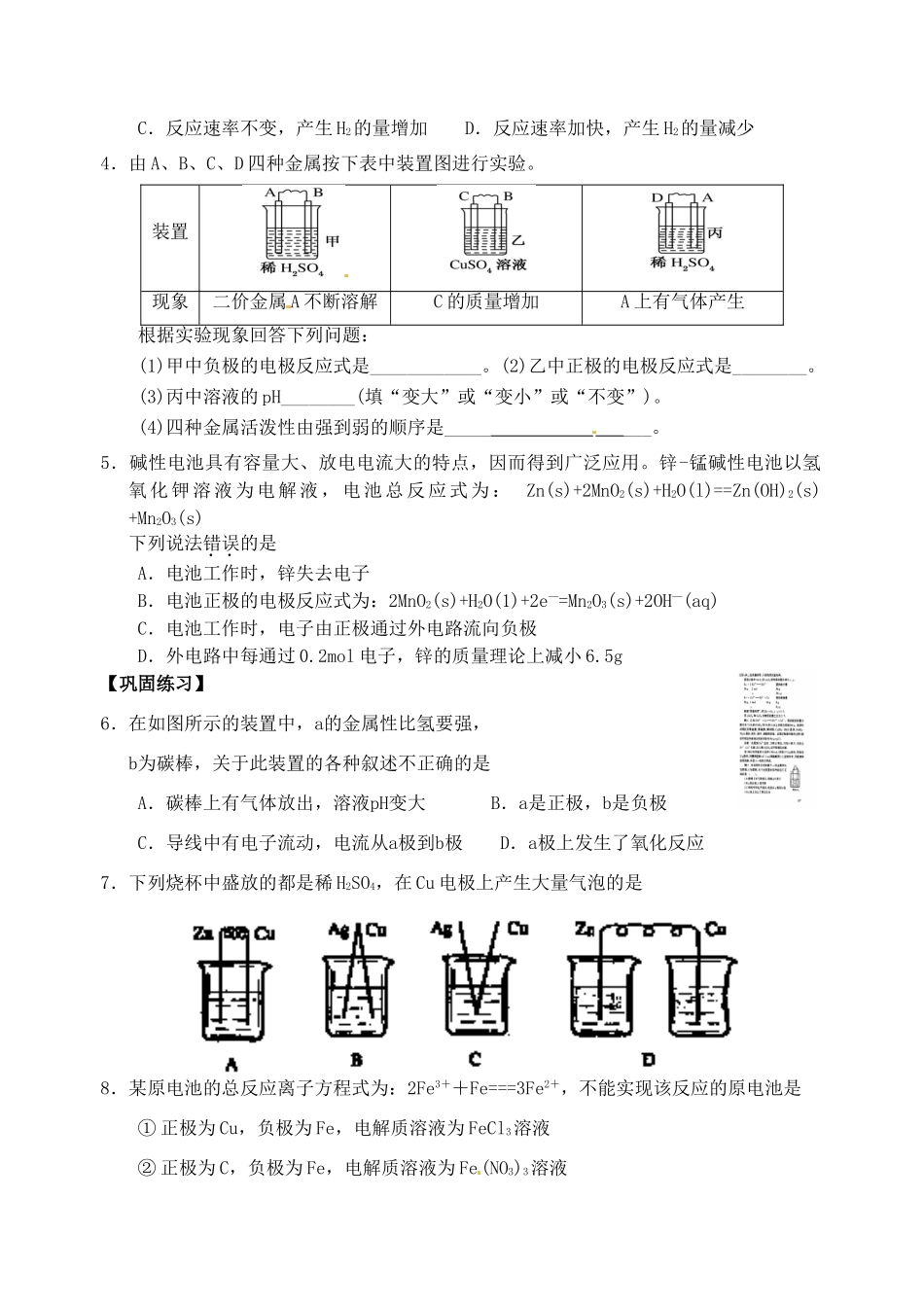
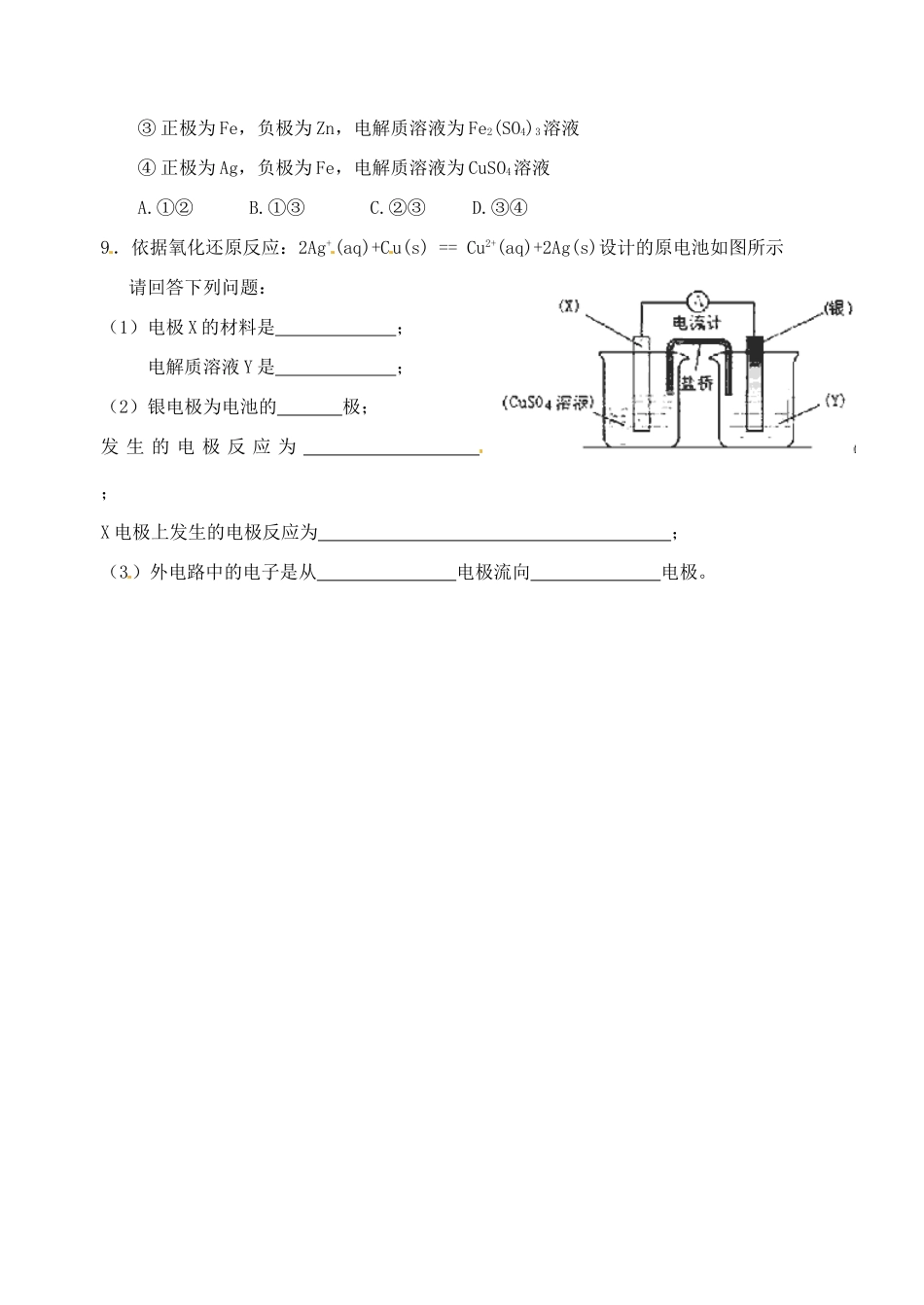
江苏省响水中学 2014 届高三化学一轮复习学案:第 30 课时 原电池【考纲要求】1.理解原电池原理;了解金属的电化学腐蚀。2.了解日常生活中常用的化学电源和新型化学电池。【考点分析】一.原电池的化学原理1.铜锌原电池工作时负极材料____;反应式_______ _ _;反应类型________正极材料____;反应式_________ _ ;反应类型________总反应式_______ _ ____溶液中离子定向移动方向:阳离子→ ,阴离子→ 变式:如右图(带有盐桥),下列叙述正确的是 A.正极反应为:Zn—2e-=Zn2+ B.电池反应为:Zn+Cu2+=Zn2+ + Cu C.在外电路中,电子从负极流向正极 D.盐桥中的 K+移向 ZnSO4溶液二.原电池的形成条件2.下列装置属于原电池的是 三.原电池原理的应用3.锌和足量的稀盐酸反应时,加入少量 CuSO4固体,下列叙述正确的是A.反应速率减慢,产生 H2的量不变 B.反应速率加快,产生 H2的量不变C.反应速率不变,产生 H2的量增加 D.反应速率加快,产生 H2的量减少4.由 A、B、C、D 四种金属按下表中装置图进行实验。装置现象二价金属 A 不断溶解C 的质量增加A 上有气体产生根据实验现象回答下列问题:(1)甲中负极的电极反应式是____________。(2)乙中正极的电极反应式是________。(3)丙中溶液的 pH________(填“变大”或“变小”或“不变”)。(4)四种金属活泼性由强到弱的顺序是_____ ___。5.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧 化 钾 溶 液 为 电 解 液 , 电 池 总 反 应 式 为 : Zn(s)+2MnO2(s)+H2O(l)==Zn(OH)2(s)+Mn2O3(s)下列说法错误的是 A.电池工作时,锌失去电子 B.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e—=Mn2O3(s)+2OH—(aq) C.电池工作时,电子由正极通过外电路流向负极 D.外电路中每通过 0.2mol 电子,锌的质量理论上减小 6.5g【巩固练习】6.在如图所示的装置中,a的金属性比氢要强,b为碳棒,关于此装置的各种叙述不正确的是 A.碳棒上有气体放出,溶液pH变大 B.a是正极,b是负极 C.导线中有电子流动,电流从a极到b极 D.a极上发生了氧化反应7.下列烧杯中盛放的都是稀 H2SO4,在 Cu 电极上产生大量气泡的是 8.某原电池的总反应离子方程式为:2Fe3++Fe===3Fe2+,不能实现该反应的原电池是① 正极为 Cu,负极为 Fe,电解质溶液为 FeCl3溶液② 正极为 C,负极为 Fe,电解质溶液为 Fe(NO...