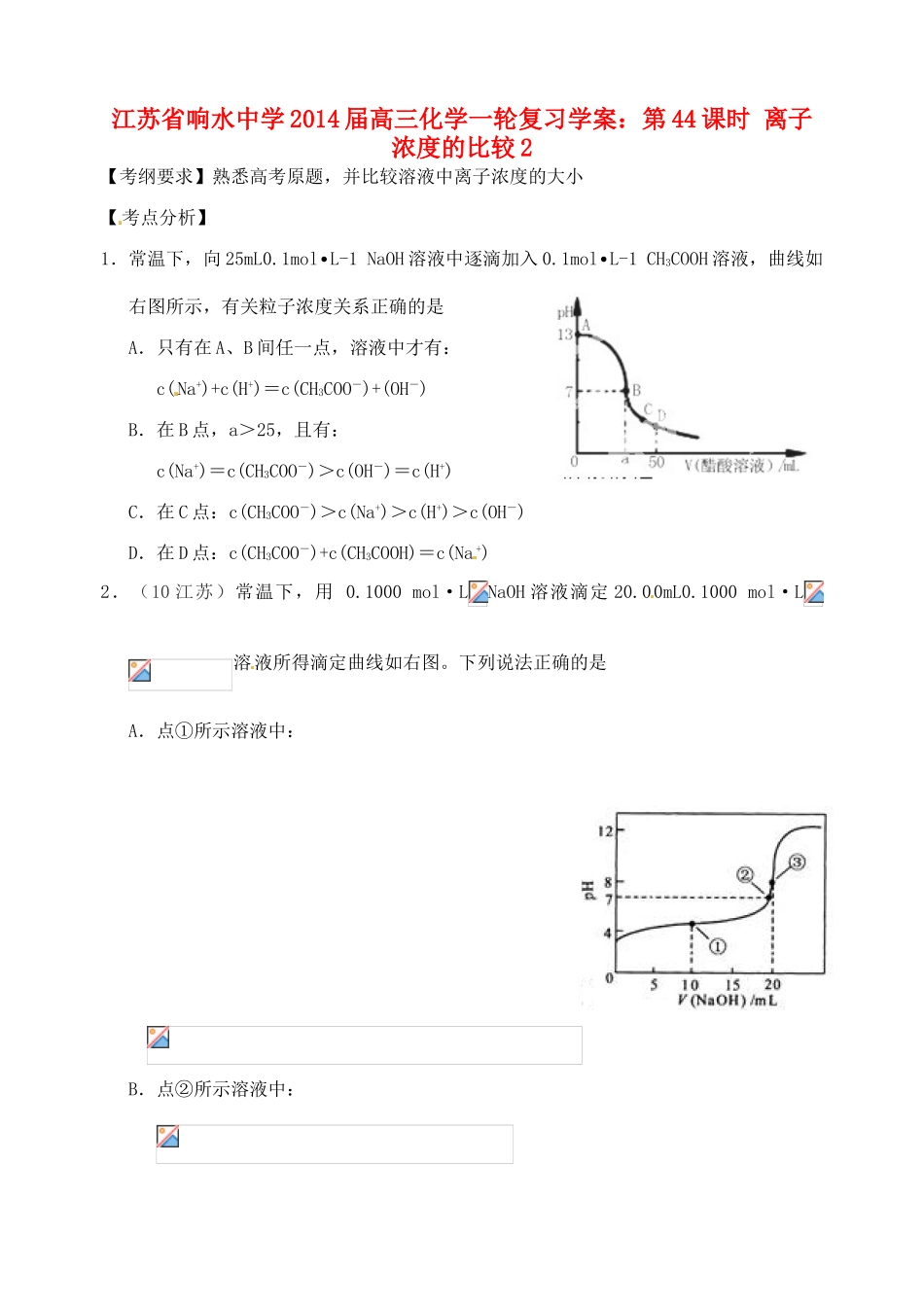
江苏省响水中学 2014 届高三化学一轮复习学案:第 44 课时 离子浓度的比较 2【考纲要求】熟悉高考原题,并比较溶液中离子浓度的大小【考点分析】1.常温下,向 25mL0.1mol L-1 NaOH∙溶液中逐滴加入 0.1mol L-1 CH∙3COOH 溶液,曲线如右图所示,有关粒子浓度关系正确的是 A.只有在 A、B 间任一点,溶液中才有:c(Na+)+c(H+)=c(CH3COO-)+(OH-) B.在 B 点,a>25,且有:c(Na+)=c(CH3COO-)>c(OH-)=c(H+)C.在 C 点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)D.在 D 点:c(CH3COO-)+c(CH3COOH)=c(Na +)2.(10 江苏)常温下,用 0.1000 mol·LNaOH 溶液滴定 20.00mL0.1000 mol·L溶液所得滴定曲线如右图。下列说法正确的是A.点①所示溶液中:B.点②所示溶液中:C.点③所示溶液中:D.滴定过程中可能出现:3.(09 江苏)下列溶液中微粒的物质的量浓度关系正确的是A . 室 温 下 , 向 0.01溶 液 中 滴 加溶 液 至 中 性 :B.0.1溶液:C.溶液:D.25℃时,、浓度均为 0.1的混合溶液:4.(11 江苏)下列有关电解质溶液中微粒的物质的量浓度关系正确的是A.在 0.1mol·L-1NaHCO3溶液中:c(Na+) c(HCO3+) c(CO32-) c(H2CO3)B.在 0.1mol·L-1Na2CO3溶液中:c(OH-)- c(H+)= c(HCO3-)+2c(H2CO-)C.向 0.2 mol·L-1NaHCO3溶液中加入等体积 0.1mol·L-1NaOH 溶液:c(Na+)= c(CH3COO-)> c(CH3COOH)> c(H+)= c(OH-)D.常温下,CH3COONa 和 CH3COOH 混合溶液[pH=7, c(Na+)=0.1mol·L-1]:c(CO32-)> c(HCO3-)> c(OH-)> c(H+) 【巩固练习】5 . ( 12 江 苏 ) 有 c(CH3COOH)+c(CH3COO - )= 0. 1 mol·L-1的一组醋 酸、醋酸钠混合溶液,溶液中 c(CH3COOH)、c(CH3COO-)与 pH 的关系如图 7 所示。下列有关溶液中离子浓度关系的叙述正确的是 A. pH=5. 5 的溶液中: c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) B. W 点所表示的溶液中: c(Na+)+c(H+)= c(CH3COOH)+c(OH-) C. pH = 3. 5 的溶液中: c(Na+) +c(H+) -c(OH-) +c(CH3COOH)= 0. 1mol·L-1 D. 向 W 点所表示的 1. 0 L 溶液中通入 0. 05 mol HCl 气体(溶液体积变化可忽略): c(H+)= c(CH3COOH)+c(OH-)6.下列有关溶液中粒子浓度的关系式中,正确的是A.pH相同的①CH3COONa ②NaHCO3 ③三份溶液中的c(Na+):③>②>①B.0.1mol·L-1某二元弱酸强碱盐NaHA溶液中:c(Na+)=2c(A2-)+c(HA-)+c(H2A)C.右图中 pH=7 时:c(Na+)>c(CH3COO-) >c(OH-)=c(H+)D.右图中 a 点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH)pH051020aV(CH3COOH)/mL12874·用 0.1 mol/L CH3COOH 溶液滴定20 mL 0.1mol/L NaOH 溶液的滴定曲线