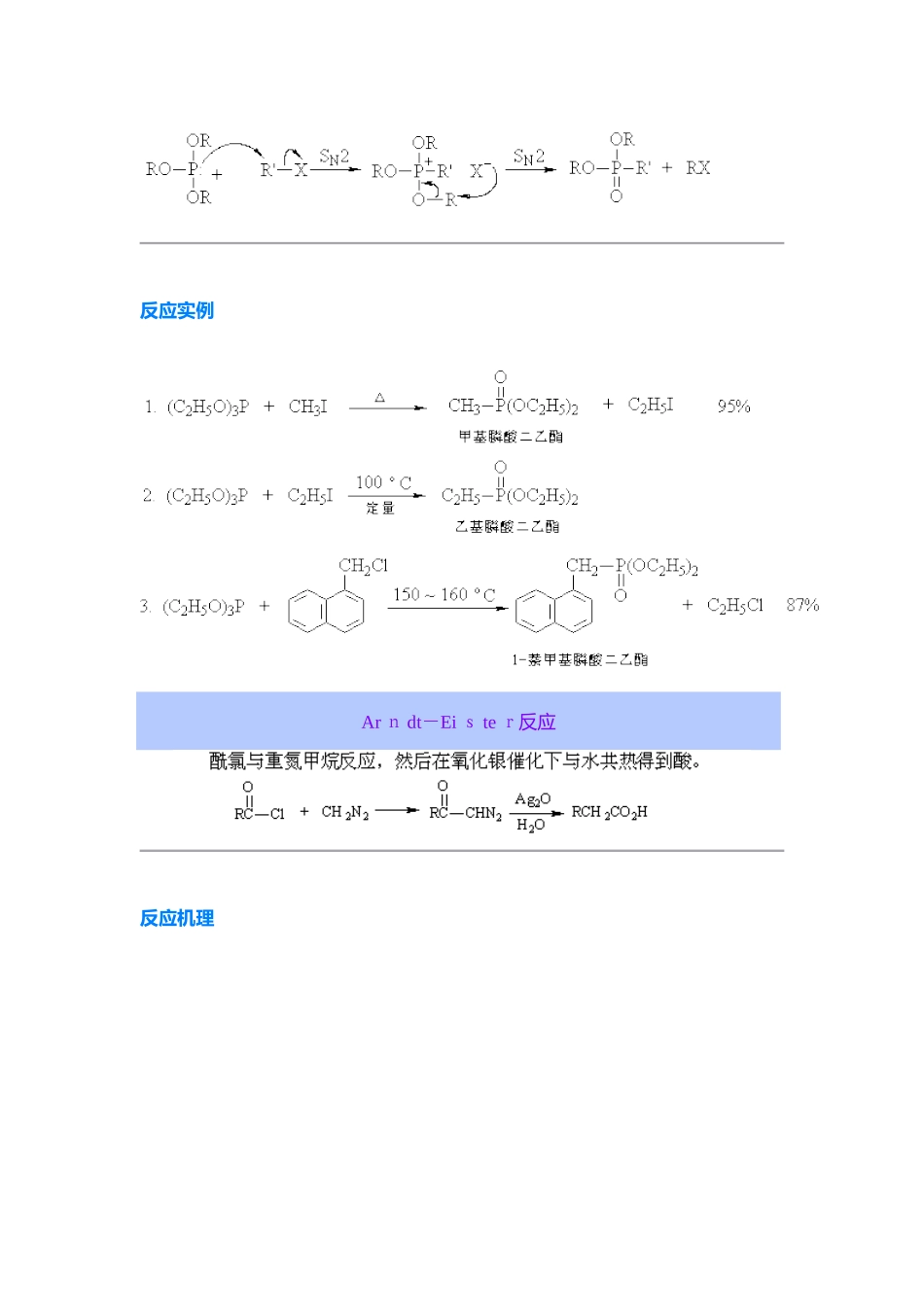
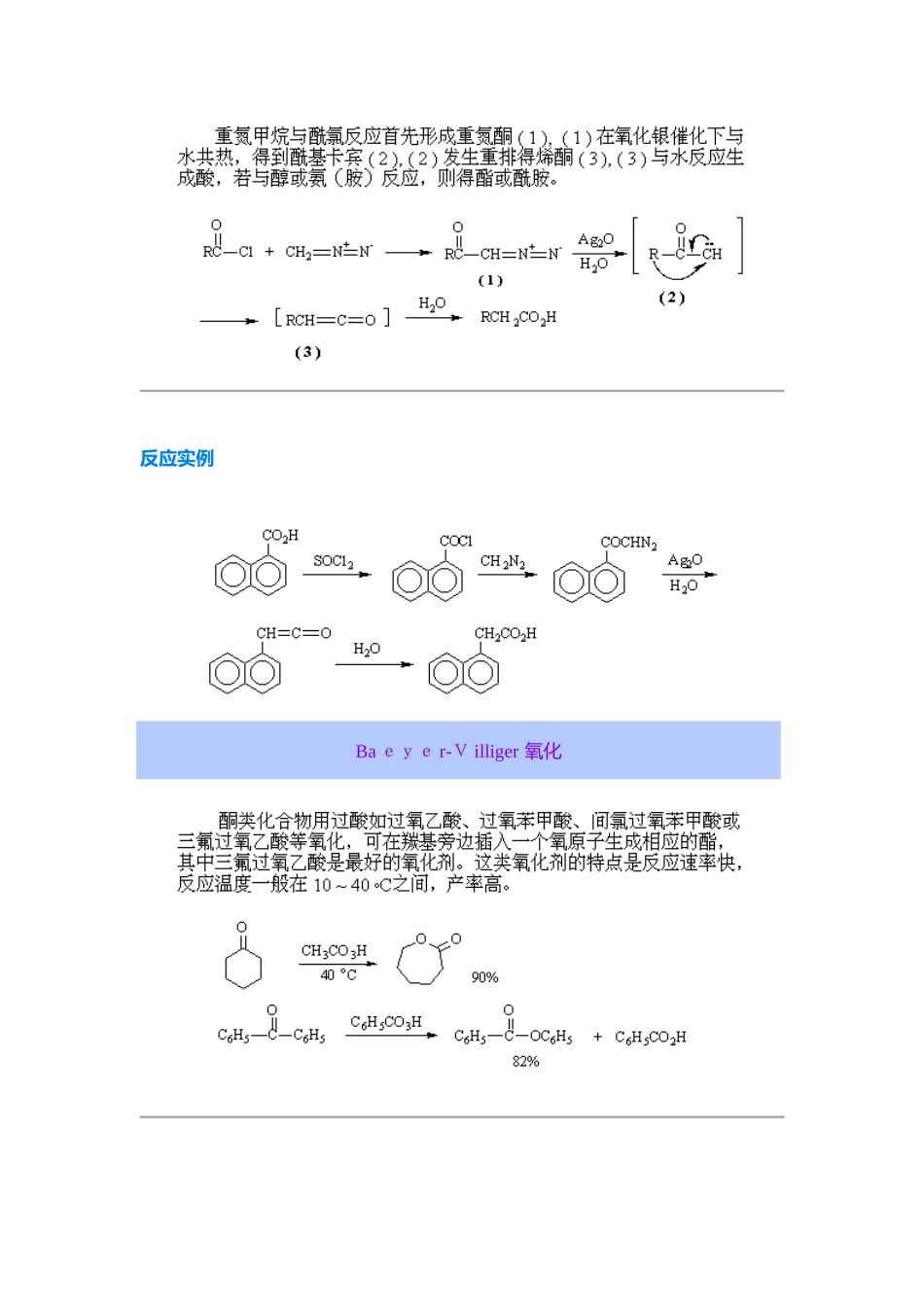
Ar b uzov 反应 亚磷酸三烷基酯作为亲核试剂与卤代烷作用,生成烷基膦酸二烷基酯与一个新得卤代烷:卤代烷反应时,其活性次序为:R'I >R'B r >R'C l。除了卤代烷外,烯丙型或炔丙型卤化物、卤代醚、 或 卤代酸酯、对甲苯磺酸酯等也可以进行反应。当亚磷酸三烷基酯中三个烷基各不相同时,总就是先脱除含碳原子数最少得基团。ﻫ 本反应就是由醇制备卤代烷得很好方法,因为亚磷酸三烷基酯可以由醇与三氯化磷反应制得:ﻫ 假如反应所用得卤代烷 R'X 得烷基与亚磷酸三烷基酯 (R O)3P 得烷基相同(即 R' = R),则 Arb u zo v 反应如下:这就是制备烷基膦酸酯得常用方法。 除了亚磷酸三烷基酯外,亚膦酸酯 RP(OR')2 与次亚膦酸酯 R 2P O R' 也能发生该类反应,例如:反应机理一般认为就是按 S N2 进行得分子内重排反应:反应实例Ar n dt-Ei s te r反应反应机理反应实例Ba eye r-V illiger 氧化反应机理反应实例B e ckmann 重排 肟在酸如硫酸、多聚磷酸以及能产生强酸得五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应得取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:反应机理 在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位得基团迁移到缺电子得氮原子上,所形成得碳正离子与水反应得到酰胺。迁移基团假如就是手性碳原子,则在迁移前后其构型不变,例如:反应实例Birch 还原反应机理反应实例Bischler-N a pie r alsk i 合成法反应机理反应实例Bo u vea u lt-Bl a nc 还原反应机理反应实例Buch e r er 反应反应机理反应实例C an n i z za ro 反应反应机理 ﻫ 反应实例 ﻫ Ch i chib a bin 反应反应机理反应实例 吡啶类化合物不易进行硝化,用硝基还原法制备氨基吡啶甚为困难。本反应就是在杂环上引入氨基得简便有效得方法,广泛适用于各种氮杂芳环,如苯并咪唑、异喹啉、吖啶与菲啶类化合物均能发生本反应。C l ai sen 重排 烯丙基芳基醚在高温(200°C)下可以重排,生成烯丙基酚。 当烯丙基芳基醚得两个邻位未被取代基占满时,重排主要得到邻位产物,两个邻位均被取代基占据时,重排得到对位产物。对位、邻位均被占满时不发生此类重排反应。 交叉反应实验证明:Claisen 重排就是分子内得重排。采纳-碳 1 4C 标记得烯丙基醚进行重排,重排后-碳原子与苯环相连,碳...