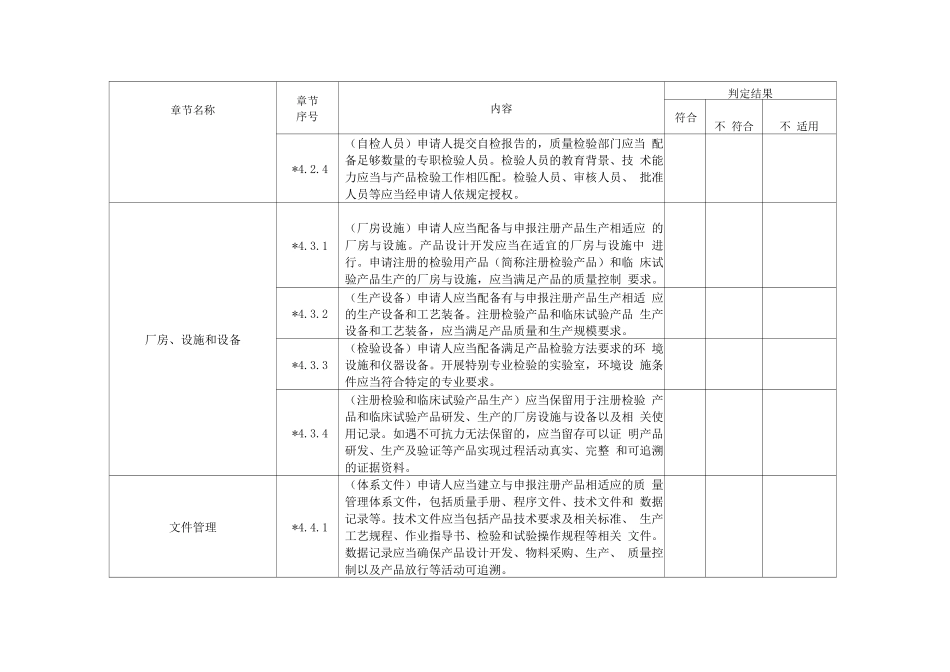
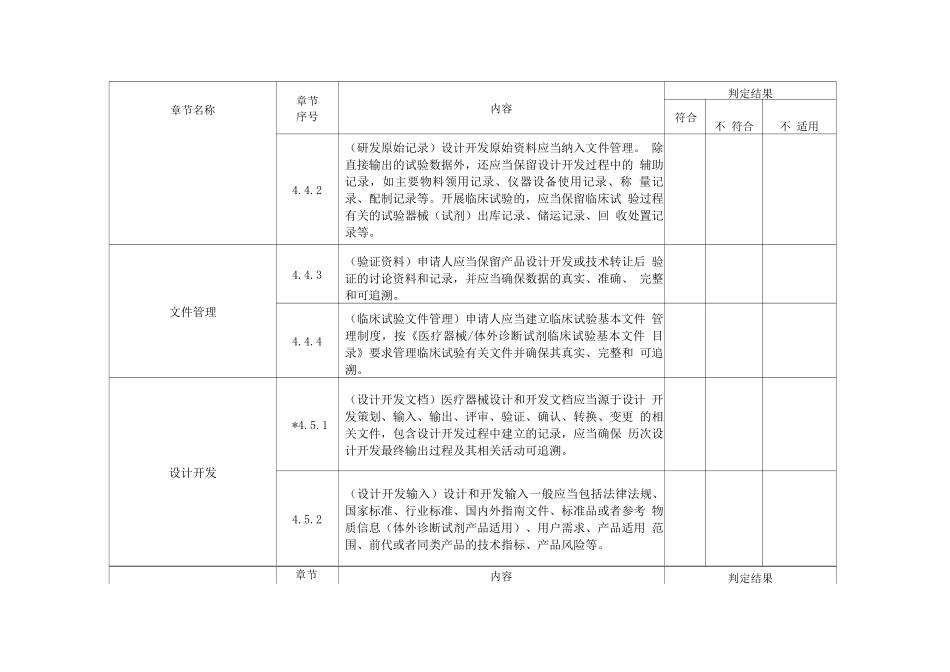
附表医疗器械注册质量管理体系核查表章节名称章节序号内容判定结果符合不 符合不 适用质量管理体系原则*4.1.1(质量管理体系)申请人应当结合产品特点,建立涵盖设 计开发、生产、质量控制和放行审核等与产品实现过程相 适应的质量管理体系,且应当包括委托生产(如有)、临床 评价(含临床试验)等。4.1.2(风险管理)申请人应当建立风险管理制度,根据科学知 识及经验对产品实现过程的质量风险进行评估,以保证产 品质量。*4.1.3(自检)申请人开展自检的,自检工作应当纳入产品质量 管理体系并符合要求。机构与人员4.2.1(组织机构)申请人应当建立与医疗器械研发、生产相适 应的管理机构,明确各部门职责,确保设计开发和技术转 换合理并可追溯。4.2.2(人员)申请人应当配备适当数量并具有相应的研发、生 产和质量控制人员,人员应当具有与申报注册产品相适应 的专业知识和工作技能。机构与人员*4.2.3(关键人员)管理者代表、生产负责人、质量负责人、技 术负责人、产品放行审核人等关键人员应当熟悉申报注册 产品的关键质量控制、关键生产操作要求。章节名称章节序号内容判定结果符合不 符合不 适用*4.2.4(自检人员)申请人提交自检报告的,质量检验部门应当 配备足够数量的专职检验人员。检验人员的教育背景、技 术能力应当与产品检验工作相匹配。检验人员、审核人员、 批准人员等应当经申请人依规定授权。厂房、设施和设备*4.3.1(厂房设施)申请人应当配备与申报注册产品生产相适应 的厂房与设施。产品设计开发应当在适宜的厂房与设施中 进行。申请注册的检验用产品(简称注册检验产品)和临 床试验产品生产的厂房与设施,应当满足产品的质量控制 要求。*4.3.2(生产设备)申请人应当配备有与申报注册产品生产相适 应的生产设备和工艺装备。注册检验产品和临床试验产品 生产设备和工艺装备,应当满足产品质量和生产规模要求。*4.3.3(检验设备)申请人应当配备满足产品检验方法要求的环 境设施和仪器设备。开展特别专业检验的实验室,环境设 施条件应当符合特定的专业要求。*4.3.4(注册检验和临床试验产品生产)应当保留用于注册检验 产品和临床试验产品研发、生产的厂房设施与设备以及相 关使用记录。如遇不可抗力无法保留的,应当留存可以证 明产品研发、生产及验证等产品实现过程活动真实、完整 和可追溯的证据资料。文件管理*4.4.1(体系文件)申请人应当建立与申报注册产品相适应的质 量管理体系...