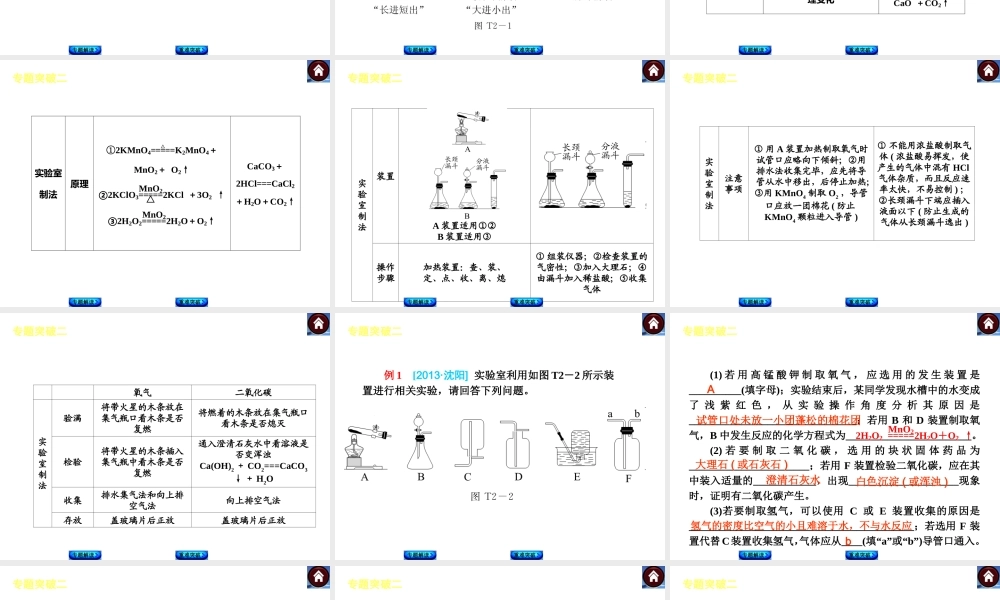
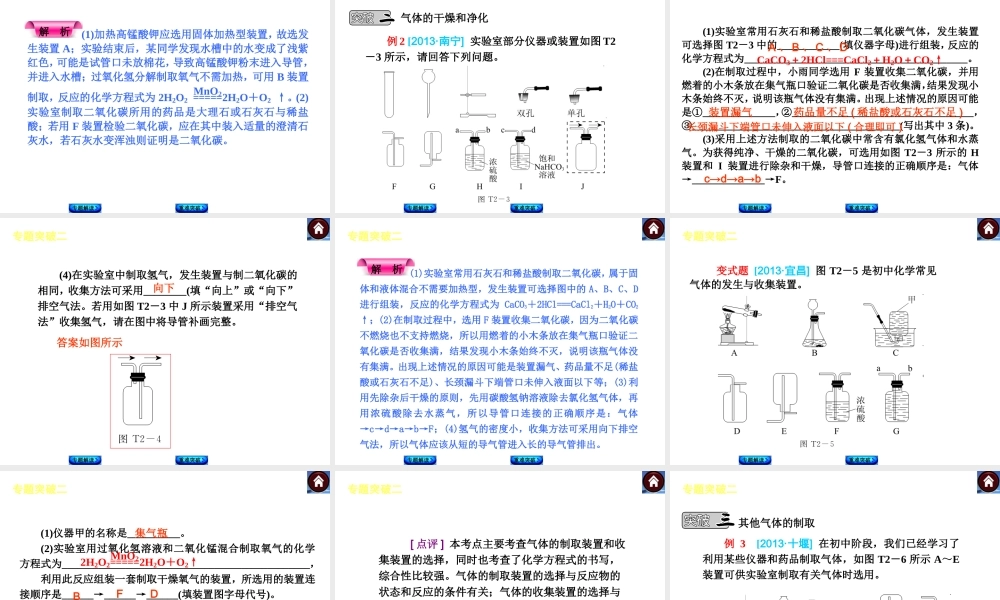
专题突破二 气体的实验室制法专 题 解 读专 题 解 读重 难 突 破重 难 突 破专 题 解 读 专题解读重难突破专题突破二┃气体的实验室制法气体的实验室制法是中考化学的常见考点,要求学生掌握实验室制取气体(氧气和二氧化碳)的反应原理、发生装置、收集方法、验满、检验、干燥和净化等。 实验室气体制备的基本思路和方法: 1.确定气体的实验室制法的反应原理。即在实验室条件下(常温、加热、加催化剂等),可用什么药品、通过什么反应来制取。 专题突破二┃气体的实验室制法2.确定制取气体的实验装置。 发生装置应依据反应物的状态和反应条件来确定。 ①若反应物为固体(一种或多种),反应条件为加热或高温,则采用“固+固加热”型装置,如氯酸钾和二氧化锰混合加热(或高锰酸钾加热)制取氧气的装置。 ②若反应物为固体和液体,反应条件为常温,则采用“固+液不加热”型装置,如用过氧化氢溶液和二氧化锰制取氧气(或用碳酸钙和稀盐酸制取二氧化碳)的装置。 专题解读重难突破专题突破二┃气体的实验室制法3.确定气体的收集方法 收集方法依据气体的密度和溶解性来确定。 ①排水法:气体难溶于水或不易溶于水。②向上排空气法:气体的密度比空气的大,且不与空气成分反应。③向下排空气法:气体的密度比空气的小,且不与空气成分反应。 4.确定气体的检验、验满方法。 5.气体的干燥和净化。 (1)常见的干燥剂及可干燥的气体 ①酸性干燥剂——浓硫酸:可干燥 H2、O2、CO、CO2、SO2、HCl;不能干燥 NH3。 专题解读重难突破专题突破二┃气体的实验室制法②碱性干燥剂——碱石灰(CaO、NaOH 的固体混合物)、生石灰(CaO):可干燥 H2、O2、CO、NH3;不能干燥 CO2、SO2、HCl。③中性干燥剂——无水 CaCl2(不能干燥 NH3)、无水 CuSO4:可干燥H2、O2、CO、CO2、SO2、HCl 等。④铁粉干燥剂;用来吸收水分和氧气,保持食品的干燥并防止变质。(2)常见气体的净化试剂①除 CO2:可用 NaOH 溶液。②除 HCl:可用 NaOH 溶液、Na2CO3溶液、NaHCO3 溶液、水。③除 H2 :先用灼热的 CuO 将其氧化为水,再用浓硫酸或碱石灰吸收。④除 CO:先用灼热的 CuO 将其氧化为 CO2,再用 NaOH 溶液吸收。⑤除 O2:可用灼热的 Cu 网。专题解读重难突破专题突破二┃气体的实验室制法[注意] 净化气体所用的试剂应根据气体的性质来选定。吸收的试剂只能吸收杂质气体,不能吸收待净化的气体。 (3)常见的干燥、净化装置 专...