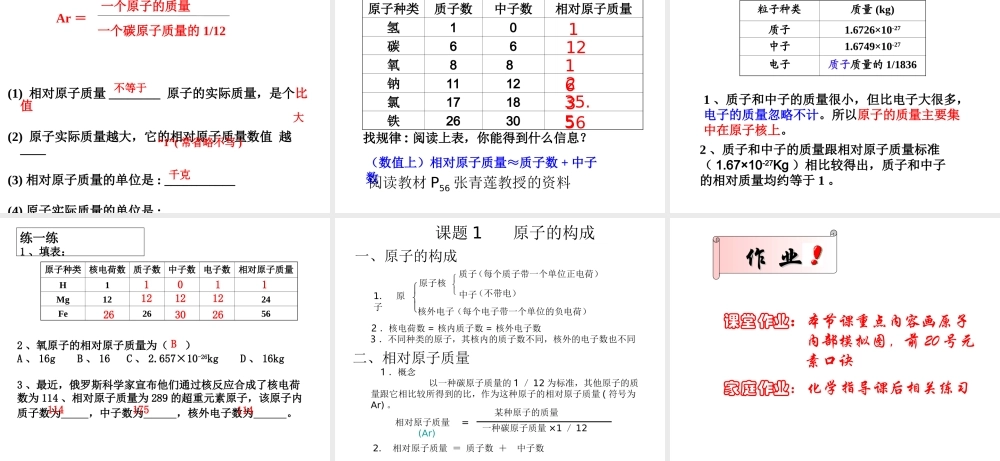
分子的性质:1. 分子的质量和体积都很小2. 分子在不断地运动, 温度升高,分子的运动加快3. 分子间有间隔混合物是由不同种分子构成,纯净物是由同种分子构成;物理变化 :分子种类没有变化分子种类发生变化化学变化 : 原子还可以再分吗? 原子究竟是什么样子呢? 今天,咱们就来畅游原子的世界!化学变化的实质:分子分成原子,原子重新组合成新的分子。在化学变化中 , 分子可以分,原子不可分 第一课时一、原子的构成原 子电 子原子核质 子中 子(带正电)(不显电性) ( 1 个电子带 1 个单位负电荷) ( 1 个质子带1 个单位正电荷)(不带电) 1 、原子的结构卢瑟福实验 α 粒子轰击金箔 (1911年 )高速 α 粒子流大多数 α 粒子( + )穿过金箔,一小部分改变原来的方向,极少数被反弹回来。说明原子内部有较大空间,在其中心存在体积很小的正电粒子化学指导用书55 页你能运用所学的知识来解释这些现象吗?原子种类 质子数 中子数核外电子数核电荷数原子序数氢10111碳66666氧88 888钠1112111111氯1718171717观察表格 ( 表 3-1), 思考下列问题2. 不同原子之间有哪些区别?3. 所有原子都是由质子、中子、电子构成的吗?原子里质子数不同,原子种类也不同。不是所有的原子都有中子。如氢原子1. 以氧原子为例 , 说明原子的构成 , 氧原子为什么不显电性原子种类 质子数 中子数核外电子数核电荷数原子序数氢10111碳66666氧88 888钠1112111111氯1718171717观察表格 ( 表 3-1), 思考下列问题4. 质子数、中子数在数量上有什么关系?5. 质子数、电子数、核电荷数、原子序数有什么联系?质子数不一定等于中子数。质子数 = 核外电子数 = 核电荷数 = 原子序数1. 原子是由居于原子中心、带 _____ 的原子核和核外带 _____ 的电子构成,原子核是由 _____ 和 _____ 构成。由于它们所带的电荷 _____ ,电性 ____ ,所以整个原子 _____( 填显或不显 ) 电性。2. 能保持物质的化学性质的最小粒子是 ____ ;化学变化中的最小粒子是 _____ ;原子中带正电荷的粒子是 _ _________ ;不显电性的粒子有 、 、 。3. 据报道, 1994 年 12 月科学家发现了一种新元素,它的原子核内有 111 个质子, 161 个中子,则该元素核外电子数是 _____ 。正电负电质子中子相等相反不显分子原子质子和原子核中子111原子分子资料:几种原子的质量一个碳原子的质量是:0 . 000...