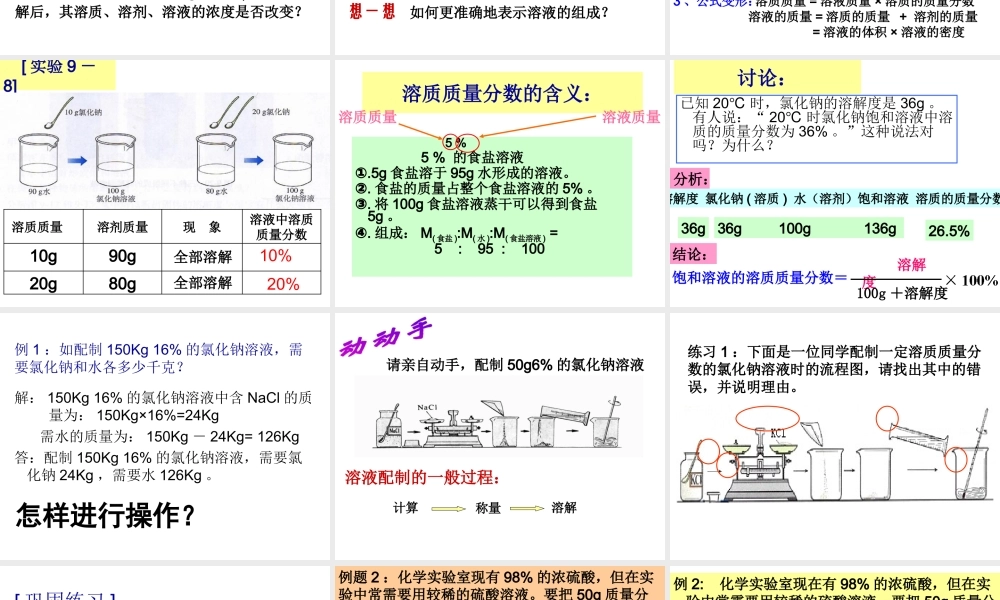
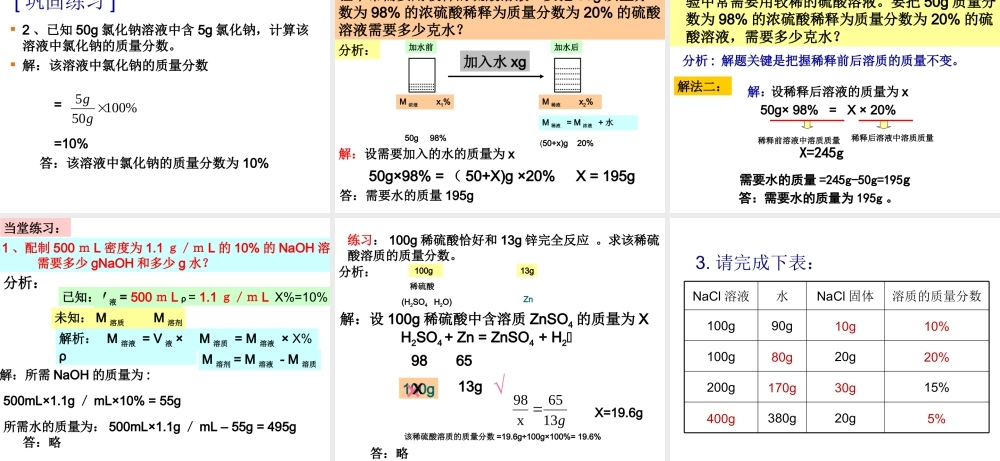
课题 3 温故而知新1 、饱和溶液 在一定温度下、一定量的溶剂中,溶质不能继续溶解某种溶质的溶液。2 、饱和溶液和不饱和溶液之间的相互转化方法不饱和溶液 饱和溶液蒸发溶剂 增加溶质 降低温度增加溶剂升高温度3 、固体溶解度在一定温度下,某固态物质在 100 克溶剂里达 到饱和状态时所溶解的质量, 叫做这种物质在这种溶剂里的溶解度。4 、气体溶解度指该气体的压强为 101KPa 和一定温度时,在 1体积水里溶解达到饱和状态时的气体体积。观察上图中的溶液,你能想到什么?硫 酸 铜溶液[ 实验9-7]试管编号溶液颜色溶剂质量溶质质量溶液质量( 1 )浅200.120.1( 2 )较浅200.520.5( 3 )较深20222( 1 ) ( 2 ) ( 3 ) 回答并分析问题:1 、三种溶液的颜色不一样。2 、三种溶液的组成不相同。3 、根据三种溶液的颜色深浅。浓溶液颜色深一点,稀溶液颜色浅一点。问:浓溶液和稀溶液是什么呢?溶液质量 = 溶质质量 + 溶剂质量将一烧杯 150g 的 CuSO4 溶液分成三等份。1、每一份溶液的浓度是否改变?2、向第1份溶液中加入 10g 水,其溶质、溶剂、溶液的浓度是否改变?3、将第二份溶液蒸发掉 10 g 水4、向第3份溶液中加入 5g CuSO4 ,完全溶解后,其溶质、溶剂、溶液的浓度是否改变?试一试 想一想变大变大不变变大变大减少减少不变变小增加增加 不变不变减少减少减少加入 5g CuSO4蒸去水加水 10g每一份溶液浓度溶液质量溶剂质量溶质质量想一想如何更准确地表示溶液的组成?“ 浓溶液”和“稀溶液”是由溶质和溶剂共同决定的,表示溶液里相对溶质的含量多少。浓溶液稀溶液饱和溶液不饱和溶液一、溶液的浓度1 、定义:溶质的质量分数溶质的体积分数溶质的质量分数 = ×100 %溶质质量溶液质量二、溶质的质量分数3 、公式变形:一定量的溶液里所含溶质的量2 、表示方法:1 、定义:溶质的质量与溶液的质量之比2 、公式:溶质质量 = 溶液质量 × 溶质的质量分数溶液的质量 = 溶质的质量 + 溶剂的质量 = 溶液的体积 × 溶液的密度 [ 实验 9 -8]10%20%溶质质量 溶剂质量现 象溶液中溶质质量分数10g90g20g80g全部溶解全部溶解溶质质量分数的含义: 5 % 5 % 的食盐溶液①.5g 食盐溶于 95g 水形成的溶液。②. 食盐的质量占整个食盐溶液的 5% 。③. 将 100g 食盐溶液蒸干可以得到食盐5g 。④. 组成: M( 食盐 ):M( 水 ):M( 食盐溶液 )...