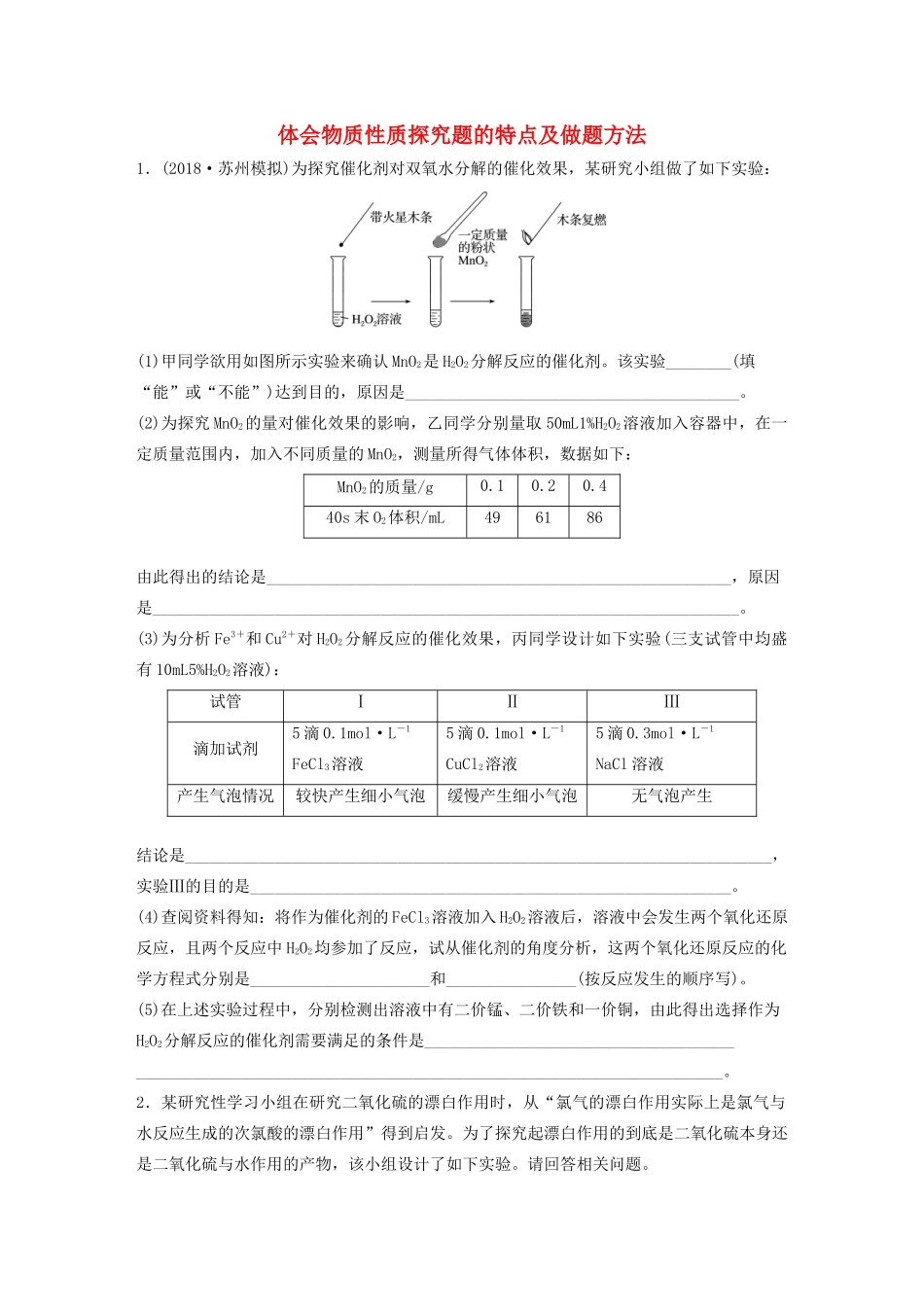
体会物质性质探究题的特点及做题方法1.(2018·苏州模拟)为探究催化剂对双氧水分解的催化效果,某研究小组做了如下实验:(1)甲同学欲用如图所示实验来确认MnO2是H2O2分解反应的催化剂。该实验________(填“能”或“不能”)达到目的,原因是_________________________________________。(2)为探究MnO2的量对催化效果的影响,乙同学分别量取50mL1%H2O2溶液加入容器中,在一定质量范围内,加入不同质量的MnO2,测量所得气体体积,数据如下:MnO2的质量/g0.10.20.440s末O2体积/mL496186由此得出的结论是_________________________________________________________,原因是________________________________________________________________________。(3)为分析Fe3+和Cu2+对H2O2分解反应的催化效果,丙同学设计如下实验(三支试管中均盛有10mL5%H2O2溶液):试管ⅠⅡⅢ滴加试剂5滴0.1mol·L-1FeCl3溶液5滴0.1mol·L-1CuCl2溶液5滴0.3mol·L-1NaCl溶液产生气泡情况较快产生细小气泡缓慢产生细小气泡无气泡产生结论是________________________________________________________________________,实验Ⅲ的目的是___________________________________________________________。(4)查阅资料得知:将作为催化剂的FeCl3溶液加入H2O2溶液后,溶液中会发生两个氧化还原反应,且两个反应中H2O2均参加了反应,试从催化剂的角度分析,这两个氧化还原反应的化学方程式分别是______________________和________________(按反应发生的顺序写)。(5)在上述实验过程中,分别检测出溶液中有二价锰、二价铁和一价铜,由此得出选择作为H2O2分解反应的催化剂需要满足的条件是______________________________________________________________________________________________________________。2.某研究性学习小组在研究二氧化硫的漂白作用时,从“氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用”得到启发。为了探究起漂白作用的到底是二氧化硫本身还是二氧化硫与水作用的产物,该小组设计了如下实验。请回答相关问题。(1)实验室用亚硫酸钠粉末跟硫酸反应制取二氧化硫,现有下列三种硫酸溶液,应选用________(填字母)。A.98%浓硫酸B.70%硫酸C.10%稀硫酸(2)为了探究干燥的SO2能否使品红褪色,该同学选择了正确的药品后设计了如图所示的实验装置,请指出实验装置设计中的不合理之处。①________________________________________________________________________;②________________________________________________________________________。(3)该同学选择了正确装置后,实验中控制二氧化硫以大约每秒3个气泡的速度通过品红的酒精溶液时,经过一小时后,品红仍不褪色。为此,你认为使品红的水溶液褪色的微粒可能是________________________________________________________________________。(4)该同学进一步实验如下:取等量相同浓度的品红水溶液于两支试管中,再分别加入少量亚硫酸钠固体和亚硫酸氢钠固体,两支试管中的品红都褪色,他得出的结论:使品红褪色的微粒肯定是HSO或SO。你认为他的结论是否正确:_______________________________,其理由是____________________________________________________________。3.(2018·贵州模拟)已知:NOx能与Na2O2反应;NO和NO2均能与酸性KMnO4溶液反应生成NO和Mn2+。Ⅰ.用如图所示装置(略去夹持仪器)可制得少量亚硝酸钠(2NO+Na2O2===2NaNO2)。(1)B、D的仪器名称是________,D的作用是_________________________________________________________________________________________________________。(2)通NO前,需先通一段时间N2,目的是_____________________________________________________________________________________________________________。(3)E中主要反应的离子方程式为_____________________________________________________________________________________________________________________。(4)常温下,测得实验前后C的质量差值为0.30g,则制得NaNO2为________g。Ⅱ.NO2和Na2O2都有较强氧化性,为探究NO2与Na...