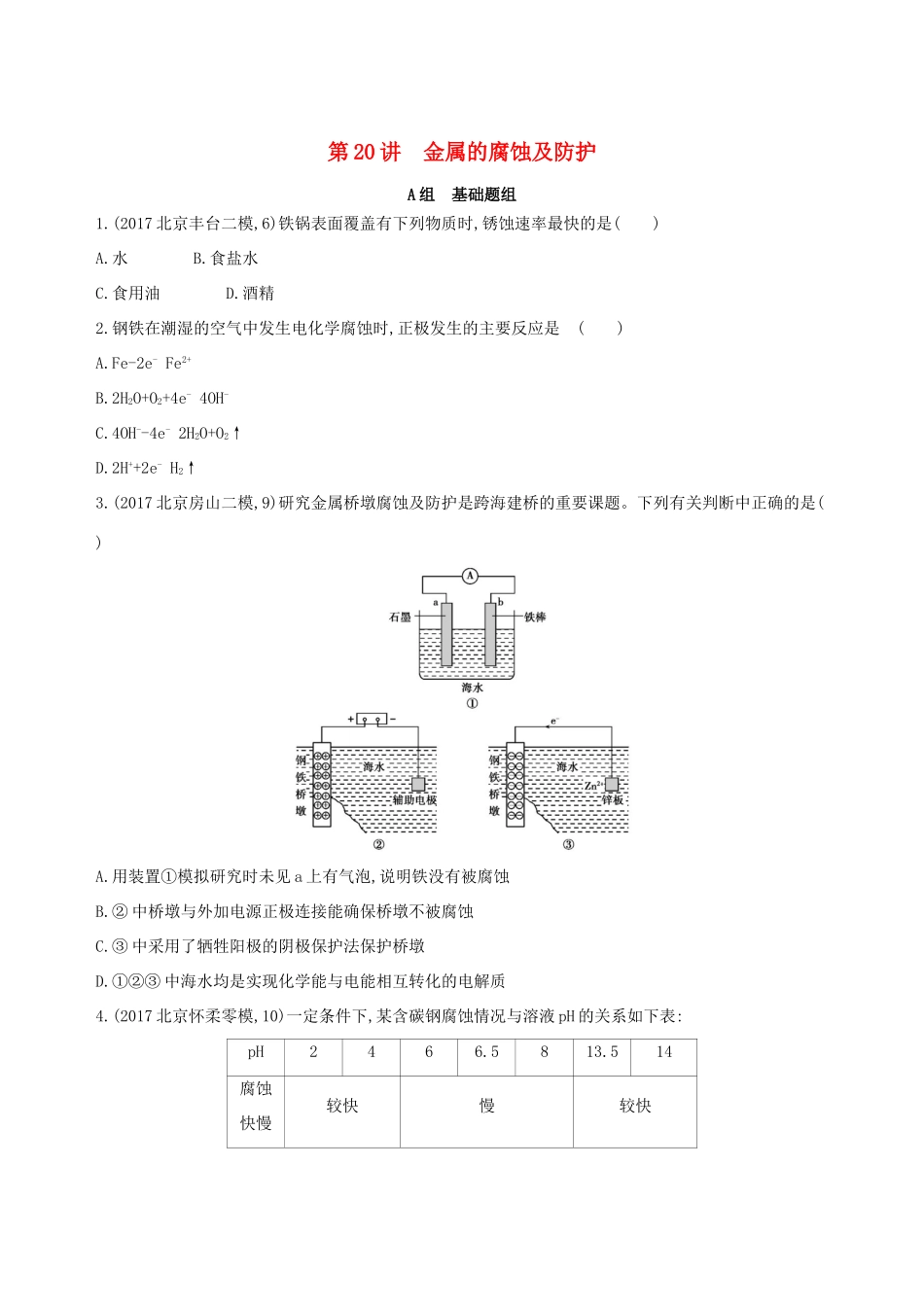
第20讲金属的腐蚀及防护A组基础题组1.(2017北京丰台二模,6)铁锅表面覆盖有下列物质时,锈蚀速率最快的是()A.水B.食盐水C.食用油D.酒精2.钢铁在潮湿的空气中发生电化学腐蚀时,正极发生的主要反应是()A.Fe-2e-Fe2+B.2H2O+O2+4e-4OH-C.4OH--4e-2H2O+O2↑D.2H++2e-H2↑3.(2017北京房山二模,9)研究金属桥墩腐蚀及防护是跨海建桥的重要课题。下列有关判断中正确的是()A.用装置①模拟研究时未见a上有气泡,说明铁没有被腐蚀B.②中桥墩与外加电源正极连接能确保桥墩不被腐蚀C.③中采用了牺牲阳极的阴极保护法保护桥墩D.①②③中海水均是实现化学能与电能相互转化的电解质4.(2017北京怀柔零模,10)一定条件下,某含碳钢腐蚀情况与溶液pH的关系如下表:pH2466.5813.514腐蚀快慢较快慢较快主要产物Fe2+Fe3O4Fe2O3Fe下列说法正确的是()A.随pH的升高,含碳钢腐蚀速率逐渐加快B.pH<4,发生析氢腐蚀C.pH为14,其负极反应为2H2O+Fe-3e-Fe+4H+D.pH为7时,负极反应为Fe-3e-Fe3+,生成的Fe3+被空气中的氧气氧化为Fe2O35.下列关于金属腐蚀与防护的说法不正确的是()图①图②图③A.图①,放置于干燥空气中的铁钉不会生锈B.图②,若断开电源,钢闸门将发生吸氧腐蚀C.图②,若将钢闸门与电源的正极相连,可防止钢闸门腐蚀D.图③,若金属M比Fe活泼,可防止输水管腐蚀6.以NaCl为主要成分的融雪剂会腐蚀桥梁、铁轨等钢铁设备。某研究小组探究NaCl溶液对钢铁腐蚀的影响。(1)将滤纸用3.5%的NaCl溶液润湿,涂上铁粉、碳粉的混合物,贴在表面皿上。在滤纸上加几滴检验试剂,再缓慢加入NaCl溶液至没过滤纸,操作如下所示:①实验Ⅰ的现象说明,得电子的物质是。②碳粉的作用是。③为了说明NaCl的作用,需要补充的对照实验是。(2)向图示装置的烧杯a、b中各加入30mL3.5%的NaCl溶液,闭合K,指针未发生偏转。加热烧杯a,指针向右偏转。①取a、b中溶液少量,滴加K3[Fe(CN)6]溶液,a中出现蓝色沉淀,b中无变化,b中铁片作极。②加热后,指针发生偏转的原因可能是。(3)用图示装置探究不同浓度NaCl溶液对钢铁腐蚀的影响,向烧杯a、b中各加入30mL不同质量分数的NaCl溶液,实验记录如下表所示。实验ab指针偏转方向Ⅰ0.1%0.01%向右Ⅱ0.1%3.5%向左Ⅲ3.5%饱和溶液向右①Ⅱ中,b中电极上发生的电极反应式是。②Ⅲ中,铁在饱和NaCl溶液中不易被腐蚀。查阅资料可知:在饱和NaCl溶液中O2浓度较低,钢铁不易被腐蚀。设计实验证明:。(4)根据上述实验,对钢铁腐蚀有影响的因素是。B组提升题组7.(2017北京西城一模,10)生铁在pH=2和pH=4的盐酸中发生腐蚀。在密闭容器中,用压强传感器记录该过程的压强变化,如下图所示。下列说法中,不正确的是()A.两容器中负极反应均为Fe-2e-Fe2+B.曲线a记录的是pH=2的盐酸中压强的变化C.曲线b记录的容器中正极反应是O2+4e-+2H2O4OH-D.在弱酸性溶液中,生铁能发生吸氧腐蚀8.(2017北京海淀期末,10)某同学进行下列实验:操作现象取一块打磨过的生铁片,在其表面滴1滴含酚酞和K3[Fe(CN)6]的食盐水放置一段时间后,生铁片上出现如下图所示“斑痕”。其边缘处为红色,中心区域为蓝色,在两色环交界处出现铁锈下列说法不合理的是()A.生铁片发生吸氧腐蚀B.中心区:Fe-2e-Fe2+C.边缘处:O2+2H2O+4e-4OH-D.交界处:4Fe2++O2+10H2O4Fe(OH)3+8H+9.某同学做如下实验:装置图1图2现象电流计指针未发生偏转电流计指针发生偏转下列说法正确的是()A.“电流计指针未发生偏转”,说明铁片Ⅰ、铁片Ⅱ均未被腐蚀B.用K3[Fe(CN)6]溶液检验铁片Ⅲ、Ⅳ附近溶液,可判断电池的正、负极C.铁片Ⅰ、Ⅲ所处的电解质溶液浓度相同,二者的腐蚀速率相等D.铁片Ⅳ的电极反应式为Fe-3e-Fe3+10.某小组同学利用原电池装置探究物质的性质。资料显示:原电池装置中,负极反应物的还原性越强,或正极反应物的氧化性越强,原电池的电压越大。(1)同学们利用下表中装置进行实验并记录。装置编号电极A溶液B操作及现象ⅠFepH=2的H2SO4溶液连接装置后,石墨表面产生无色气泡;电压表指针偏转ⅡCupH=2的H2SO4溶液连接装置后,石墨表面无明显现象;电压表指针偏转,记录读数为a①同学们认为实验Ⅰ中铁主要发生了析氢腐蚀,其正极的电极反应式是。②针对实验Ⅱ的现象,甲同学认为不可能发生析氢腐蚀,其判断依据是;乙同学认为实...