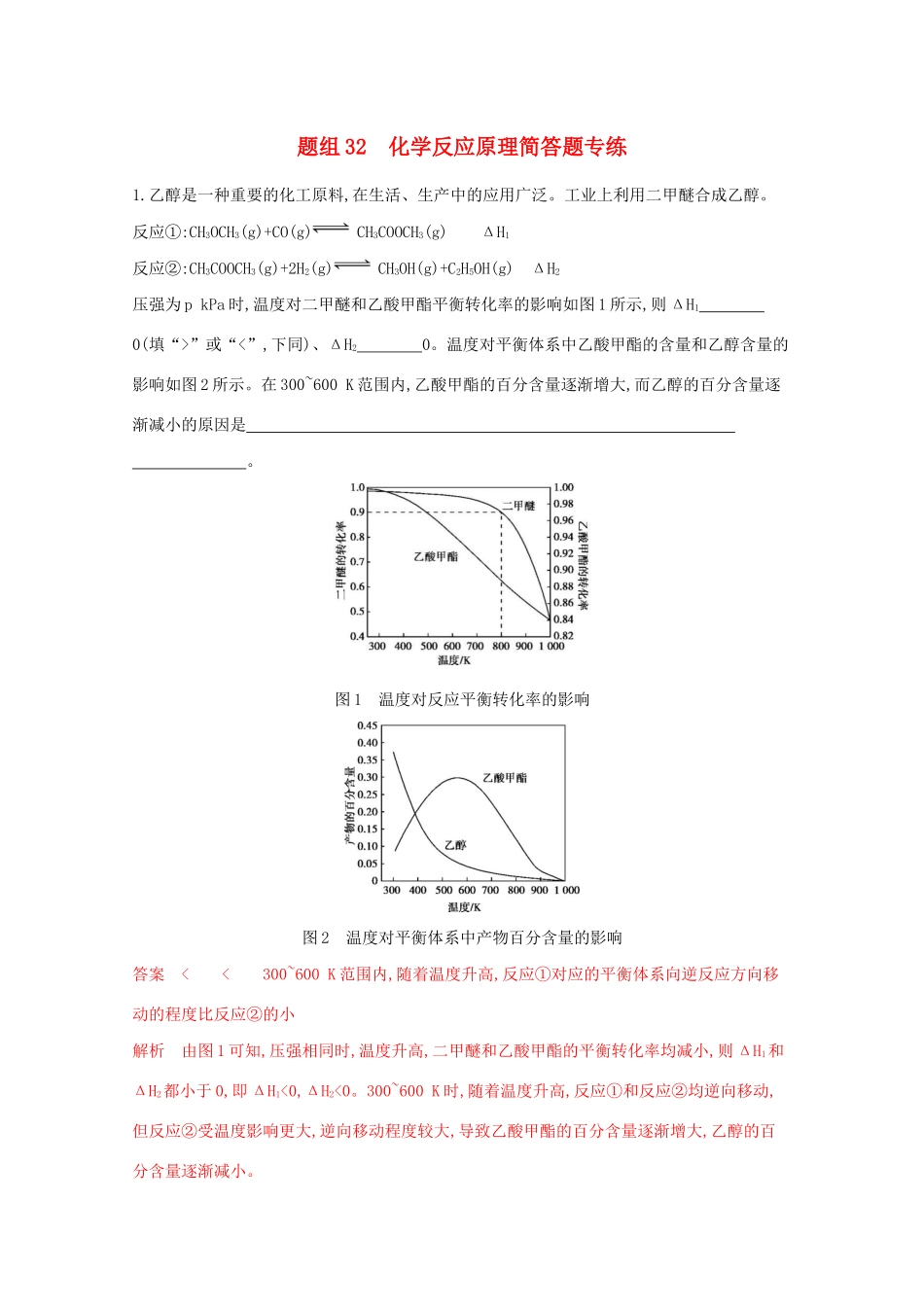
题组32化学反应原理简答题专练1.乙醇是一种重要的化工原料,在生活、生产中的应用广泛。工业上利用二甲醚合成乙醇。反应①:CH3OCH3(g)+CO(g)CH3COOCH3(g)ΔH1反应②:CH3COOCH3(g)+2H2(g)CH3OH(g)+C2H5OH(g)ΔH2压强为pkPa时,温度对二甲醚和乙酸甲酯平衡转化率的影响如图1所示,则ΔH10(填“>”或“<”,下同)、ΔH20。温度对平衡体系中乙酸甲酯的含量和乙醇含量的影响如图2所示。在300~600K范围内,乙酸甲酯的百分含量逐渐增大,而乙醇的百分含量逐渐减小的原因是。图1温度对反应平衡转化率的影响图2温度对平衡体系中产物百分含量的影响答案<<300~600K范围内,随着温度升高,反应①对应的平衡体系向逆反应方向移动的程度比反应②的小解析由图1可知,压强相同时,温度升高,二甲醚和乙酸甲酯的平衡转化率均减小,则ΔH1和ΔH2都小于0,即ΔH1<0,ΔH2<0。300~600K时,随着温度升高,反应①和反应②均逆向移动,但反应②受温度影响更大,逆向移动程度较大,导致乙酸甲酯的百分含量逐渐增大,乙醇的百分含量逐渐减小。2.用Fe作电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀以达到除铬的目的。(1)用Fe作电极的原因为。(2)在阴极附近溶液pH升高的原因是。(3)溶液中除生成Cr(OH)3沉淀外还生成沉淀是,解释产生的原因:。答案(1)阳极反应为Fe-2e-Fe2+,提供还原剂Fe2+(2)水电离产生的H+放电生成H2:2H++2e-H2↑,同时产生了大量OH-(3)Fe(OH)3溶液中的Fe2+被Cr2O72-氧化为Fe3+,电解过程中pH升高,Fe3+水解程度增大,转化为Fe(OH)3沉淀3.应对雾霾、改善空气质量需要从多方面入手,如开发利用清洁能源等。甲醇是一种可再生的清洁能源,具有广阔的开发和应用前景。一定条件下用CO和H2合成CH3OH:CO(g)+2H2(g)CH3OH(g),在2L恒容密闭容器中充入1molCO和2molH2,在催化剂作用下充分反应。图中表示平衡混合物中CH3OH的体积分数在不同压强下随温度变化的平衡曲线。回答下列问题:(1)该反应的ΔH(填“>”或“<”)0,压强的相对大小:p1(填“>”或“<”)p2。(2)压强为p2,温度为300℃时,该反应的化学平衡常数K=。(3)下列各项中,不能说明该反应已经达到平衡的是。A.容器内气体压强不再变化B.v(CO)∶v(H2)∶v(CH3OH)=1∶2∶1C.容器内气体的密度不再变化D.容器内混合气体的平均相对分子质量不再变化E.容器内各组分的质量分数不再变化(4)某温度下,在保证反应物浓度不变的情况下,增大容器的体积,平衡(填字母)。A.向正反应方向移动B.向逆反应方向移动C.不移动答案(1)<>(2)48(3)BC(4)C解析(1)由题图可知,随温度的升高,CH3OH的体积分数减小,即升温平衡向逆反应方向移动,说明逆反应吸热,则正反应放热。题给反应的正反应是气体体积减小的反应,压强增大,平衡正向移动,CH3OH体积分数增大,则p1>p2。(2)列三段式:CO(g)+2H2(g)CH3OH(g)n(起始)/mol120n(变化)/molx2xxn(平衡)/mol1-x2-2xxCH3OH的体积分数为0.5,则x1-x+2-2x+x=0.5,x=0.75,平衡时c(CO)、c(H2)、c(CH3OH)分别为0.125mol·L-1、0.25mol·L-1、0.375mol·L-1,K=0.3750.125×0.252=48。(3)A项,该反应的正反应是气体体积减小的反应,压强不变,说明达到平衡;B项,没有说明是正反应速率还是逆反应速率,无法判断;C项,质量不变,容器体积不变,密度始终不变;D项,气体总质量不变,平均相对分子质量不变,则气体总物质的量不变,说明达到平衡;E项,各组分质量分数不变,说明达到平衡。4.直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。(1)吸收液吸收SO2的过程中,pH随n(SO32-)∶n(HSO3-)的变化关系如下表:n(SO32-)∶n(HSO3-)91∶91∶19∶91pH8.27.26.2由上表判断,NaHSO3溶液显性,用化学平衡原理解释:。(2)当吸收液的pH降至约为6时,需送到电解槽再生。再生示意图如下:当阴极室中溶液pH升到8以上时,吸收液再生并循环利用。简述再生原理:。答案(1)酸NaHSO3溶液中的HSO3-存在两个平衡:HSO3-H++SO32-和HSO3-+H2OH2SO3+OH-,HSO3-的电离程度大于其水解程度(2)H+在阴极得电子生成H2,溶液中的c(H+)降低,促使HSO3-电离生成SO32-,且Na+进入阴极室,吸收液得以再生5.简要回答下列问题:(1)用于电解的食盐水需先除去其中的Ca2+、Mg2+、SO42-等杂质。某次除杂操作...