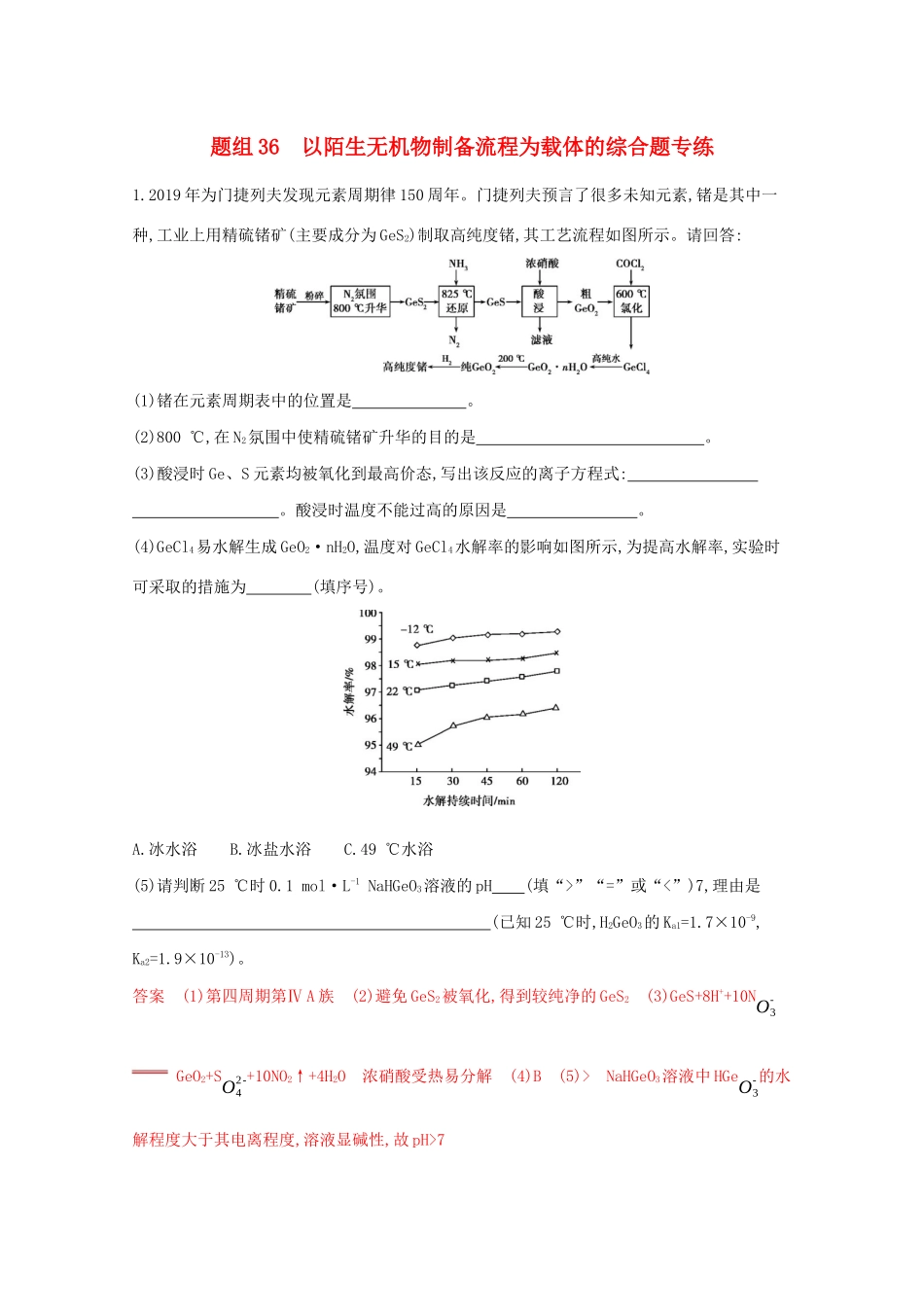
题组36以陌生无机物制备流程为载体的综合题专练1.2019年为门捷列夫发现元素周期律150周年。门捷列夫预言了很多未知元素,锗是其中一种,工业上用精硫锗矿(主要成分为GeS2)制取高纯度锗,其工艺流程如图所示。请回答:(1)锗在元素周期表中的位置是。(2)800℃,在N2氛围中使精硫锗矿升华的目的是。(3)酸浸时Ge、S元素均被氧化到最高价态,写出该反应的离子方程式:。酸浸时温度不能过高的原因是。(4)GeCl4易水解生成GeO2·nH2O,温度对GeCl4水解率的影响如图所示,为提高水解率,实验时可采取的措施为(填序号)。A.冰水浴B.冰盐水浴C.49℃水浴(5)请判断25℃时0.1mol·L-1NaHGeO3溶液的pH(填“>”“=”或“<”)7,理由是(已知25℃时,H2GeO3的Ka1=1.7×10-9,Ka2=1.9×10-13)。答案(1)第四周期第ⅣA族(2)避免GeS2被氧化,得到较纯净的GeS2(3)GeS+8H++10NO3-GeO2+SO42-+10NO2↑+4H2O浓硝酸受热易分解(4)B(5)>NaHGeO3溶液中HGeO3-的水解程度大于其电离程度,溶液显碱性,故pH>7解析(1)Ge在元素周期表中位于第四周期第ⅣA族。(2)根据题干信息可知,在N2氛围中使精硫锗矿升华的目的是避免GeS2被氧化,得到较为纯净的GeS2。(3)浓硝酸酸浸GeS时,Ge、S元素均被氧化到最高价态,则生成GeO2、SO42-,NO3-被还原为二氧化氮气体,离子方程式为GeS+8H++10NO3-GeO2+SO42-+10NO2↑+4H2O;浓硝酸受热易分解,故酸浸时温度不能过高。(4)GeCl4易水解生成GeO2·nH2O,根据题图知,温度较低时水解率较高,为提高水解率,可选用冰盐水浴。(5)已知25℃时H2GeO2的Ka1=1.7×10-9,Ka2=1.9×10-13,NaHGeO3的水解常数Kh=KwKa1=11.7×10-5>Ka2(1.9×10-13),即NaHGeO3溶液中HGeO3-的水解程度大于其电离程度,溶液显碱性,故pH>7。2.锑(Sb)及其化合物在工业上有许多用途。以辉锑矿(主要成分为Sb2S3,还含有PbS、As2S3、CuO、SiO2等)为原料制备金属锑的工艺流程如图所示:已知:①浸出液中除含过量盐酸和SbCl5之外,还含有SbCl3、PbCl2、AsCl3、CuCl2等;②常温下:Ksp(CuS)=1.27×10-36,Ksp(PbS)=9.04×10-29;③溶液中离子浓度≤1.0×10-5mol·L-1时,认为该离子沉淀完全。(1)滤渣1中除了S之外,还有(填化学式)。(2)“浸出”时,Sb2S3发生反应的化学方程式为。(3)“还原”时,被Sb还原的物质为(填化学式)。(4)常温下,“除铜、铅”时,Cu2+和Pb2+均沉淀完全,此时溶液中的c(S2-)不低于;所加Na2S也不宜过多,其原因为。(5)“除砷”时有H3PO3生成,该反应的化学方程式为。(6)“电解”时,被氧化的Sb元素与被还原的Sb元素的质量之比为。答案(1)SiO2(2)Sb2S3+3SbCl55SbCl3+3S(3)SbCl5(4)9.04×10-24mol·L-1产生H2S等污染性气体(或生成Sb2S3)(5)2AsCl3+3Na3PO2+3HCl+3H2O2As↓+3H3PO3+9NaCl(6)3∶2解析(1)SiO2不溶于盐酸,所以滤渣1中除了S之外,还有SiO2。(2)“浸出”时Sb2S3中的硫元素被SbCl5氧化为S,SbCl5被还原为SbCl3,反应的化学方程式是Sb2S3+3SbCl55SbCl3+3S。(3)“还原”时,加入适量的Sb还原“浸出”时加入的过量SbCl5,所以被Sb还原的物质为SbCl5。(4)由Ksp(CuS)=1.27×10-36,Ksp(PbS)=9.04×10-29可知,Cu2+先沉淀,当Pb2+恰好完全沉淀时,Cu2+已经完全沉淀;Pb2+完全沉淀时,c(Pb2+)≤1.0×10-5mol·L-1,Ksp(PbS)=9.04×10-29,所以此时溶液中的c(S2-)≥Ksp(PbS)c(Pb2+¿)¿=9.04×10-291.0×10-5mol·L-1=9.04×10-24mol·L-1;所加Na2S过多,会生成H2S等污染性气体或生成Sb2S3。(5)“除砷”时Na3PO2与AsCl3发生氧化还原反应生成As和H3PO3,反应的化学方程式为2AsCl3+3Na3PO2+3HCl+3H2O2As↓+3H3PO3+9NaCl。(6)“电解”时部分SbCl3在阳极被氧化为SbCl5,部分SbCl3在阴极被还原为Sb,根据得失电子守恒知,被氧化的Sb元素与被还原的Sb元素的质量之比为3∶2。