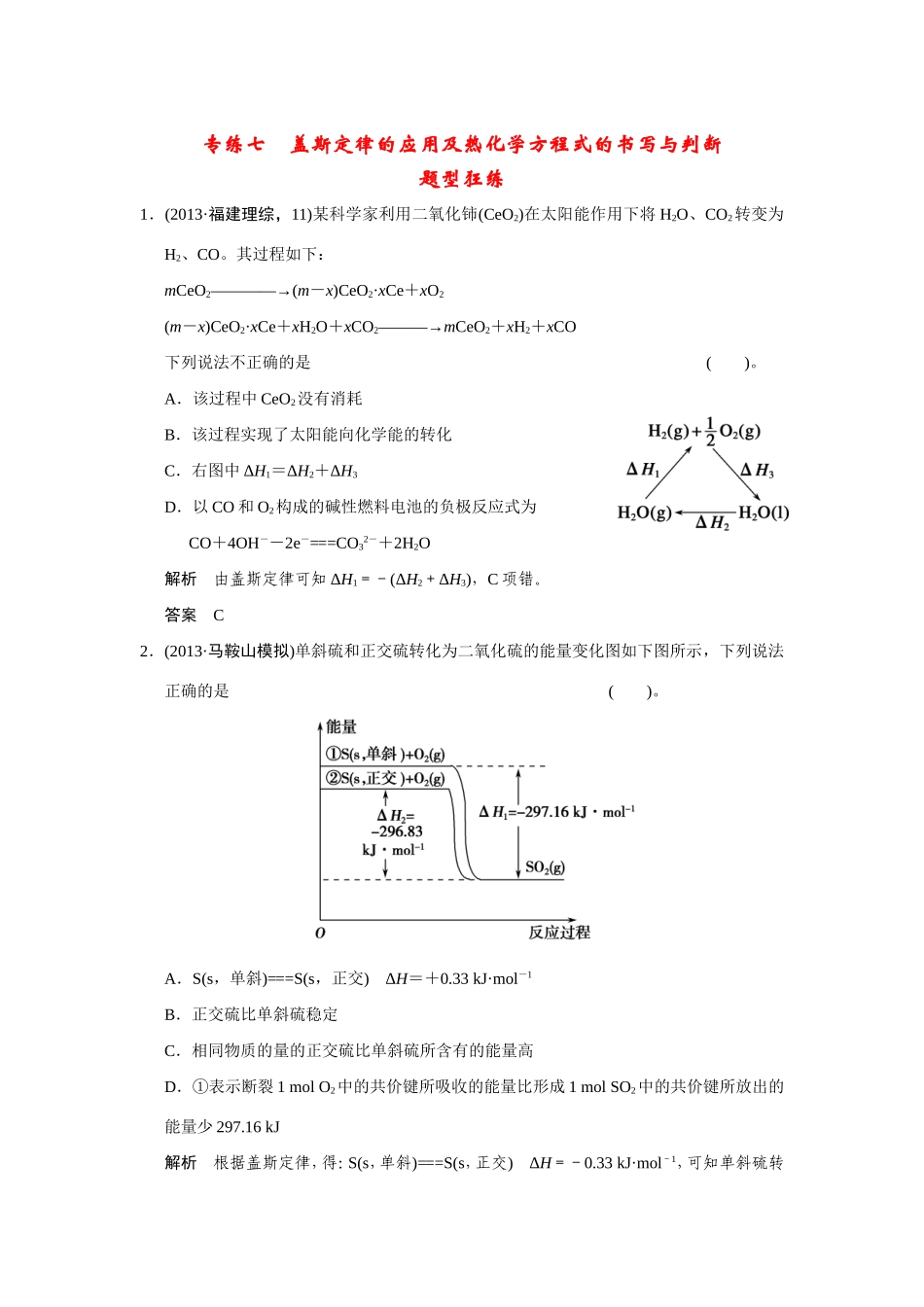
专练七盖斯定律的应用及热化学方程式的书写与判断题型狂练1.(2013·福建理综,11)某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变为H2、CO。其过程如下:mCeO2――――→(m-x)CeO2·xCe+xO2(m-x)CeO2·xCe+xH2O+xCO2―――→mCeO2+xH2+xCO下列说法不正确的是()。A.该过程中CeO2没有消耗B.该过程实现了太阳能向化学能的转化C.右图中ΔH1=ΔH2+ΔH3D.以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH--2e-===CO32-+2H2O解析由盖斯定律可知ΔH1=-(ΔH2+ΔH3),C项错。答案C2.(2013·马鞍山模拟)单斜硫和正交硫转化为二氧化硫的能量变化图如下图所示,下列说法正确的是()。A.S(s,单斜)===S(s,正交)ΔH=+0.33kJ·mol-1B.正交硫比单斜硫稳定C.相同物质的量的正交硫比单斜硫所含有的能量高D.①表示断裂1molO2中的共价键所吸收的能量比形成1molSO2中的共价键所放出的能量少297.16kJ解析根据盖斯定律,得:S(s,单斜)===S(s,正交)ΔH=-0.33kJ·mol-1,可知单斜硫转化为正交硫时要放出热量,正交硫的能量要低,较稳定,故A项错误、B项正确;相同物质的量的正交硫应该比单斜硫所含有的能量低,C项错误;①表示断裂1molS(s,单斜)和1molO2(g)中的共价键所吸收的能量比形成1molSO2(g)中的共价键所放出的能量少297.16kJ,D项错误。答案B3.(2013·北京大兴期末,19)由金红石(TiO2)制取单质Ti涉及的步骤为:TiO2―→TiCl4――→Ti已知:①C(s)+O2(g)===CO2(g)ΔH1=-393.5kJ·mol-1②2CO(g)+O2(g)===2CO2(g)ΔH2=-566kJ·mol-1③TiO2(s)+2Cl2(g)===TiCl4(s)+O2(g)ΔH3=+141kJ·mol-1则TiO2(s)+2Cl2(g)+2C(s)===TiCl4(s)+2CO(g)的ΔH是()。A.-80kJ·mol-1B.-160kJ·mol-1C.+160kJ·mol-1D.+80kJ·mol-1解析ΔH=2ΔH1-ΔH2+ΔH3=-80kJ·mol-1。答案A4.(2013·芜湖模拟)已知:①H2O(g)===H2O(l)ΔH=-Q1kJ·mol-1②C2H5OH(g)===C2H5OH(l)ΔH=-Q2kJ·mol-1③C2H5OH(g)+3O2(g)===2CO2(g)+3H2O(g)ΔH=-Q3kJ·mol-1下列判断正确是()。A.酒精的燃烧热ΔH=-Q3kJ·mol-1B.由③可知1molC2H5OH(g)的能量高于2molCO2(g)和3molH2O(g)的总能量C.H2O(g)→H2O(l)释放出了热量,所以该过程为放热反应D.23g液体酒精完全燃烧生成CO2(g)和H2O(l),释放出的热量为(0.5Q3-0.5Q2+1.5Q1)kJ·mol-1解析掌握热化学方程式表示的涵义及燃烧热的定义。燃烧热指1mol可燃物完全燃烧生成稳定的化合物时放出的热量,H2O应为液态,A错误;反应③只能说明1molC2H5OH(g)和3O2(g)的总能量高于2molCO2(g)和3molH2O(g)的总能量,B错误;H2O(g)→H2O(l)不是化学变化,C错误;由反应③-②+①×3得:C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l)ΔH=-(Q3-Q2+Q1×3)kJ·mol-1,D正确。答案D5.(2013·省城名校联考)天然气燃烧不完全会产生有毒气体CO,又知CO和CH4燃烧的热化学方程式分别为:2CO(g)+O2(g)===2CO2(g)ΔH=-566kJ·mol-1CH4(g)+2O2(g)===CO2(g)+2H2O(l)ΔH=-890kJ·mol-1又知由1molH2与O2反应生成液态H2O比生成气态H2O多放出44kJ的热量。则下列热化学方程式正确的是()。A.2CH4(g)+O2(g)===CO2(g)+CO(g)+4H2O(l)ΔH=-1214kJ·mol-1B.2CH4(g)+O2(g)===CO2(g)+CO(g)+4H2O(g)ΔH=-1038kJ·mol-1C.3CH4(g)+5O2(g)===CO2(g)+2CO(g)+6H2O(l)ΔH=-1538kJ·mol-1D.3CH4(g)+5O2(g)===CO2(g)+2CO(g)+6H2O(g)ΔH=-1840kJ·mol-1解析根据题意写出有关反应的热化学方程式如下:(1)2CO(g)+O2(g)===2CO2(g)ΔH1=-566kJ·mol-1(2)CH4(g)+2O2(g)===CO2(g)+2H2O(l)ΔH2=-890kJ·mol-1(3)H2O(g)===H2O(l)ΔH3=-44kJ·mol-1(4)CH4(g)+2O2(g)===CO2(g)+2H2O(g)ΔH4=?(5)CH4(g)+O2(g)===CO(g)+2H2O(l)ΔH5=?(4)=(2)-(3)×2,可求ΔH4=-890kJ·mol-1+88kJ·mol-1=-802kJ·mol-1(5)=(2)-(1)×,可求ΔH5=-890kJ·mol-1+283kJ·mol-1=-607kJ·mol-1A中ΔH=ΔH2+ΔH5=-1497kJ·mol-1,故A错,同理,B为-1321kJ·mol-1,C为-2104kJ·mol-1,D为-1840kJ·mol-1。答案D