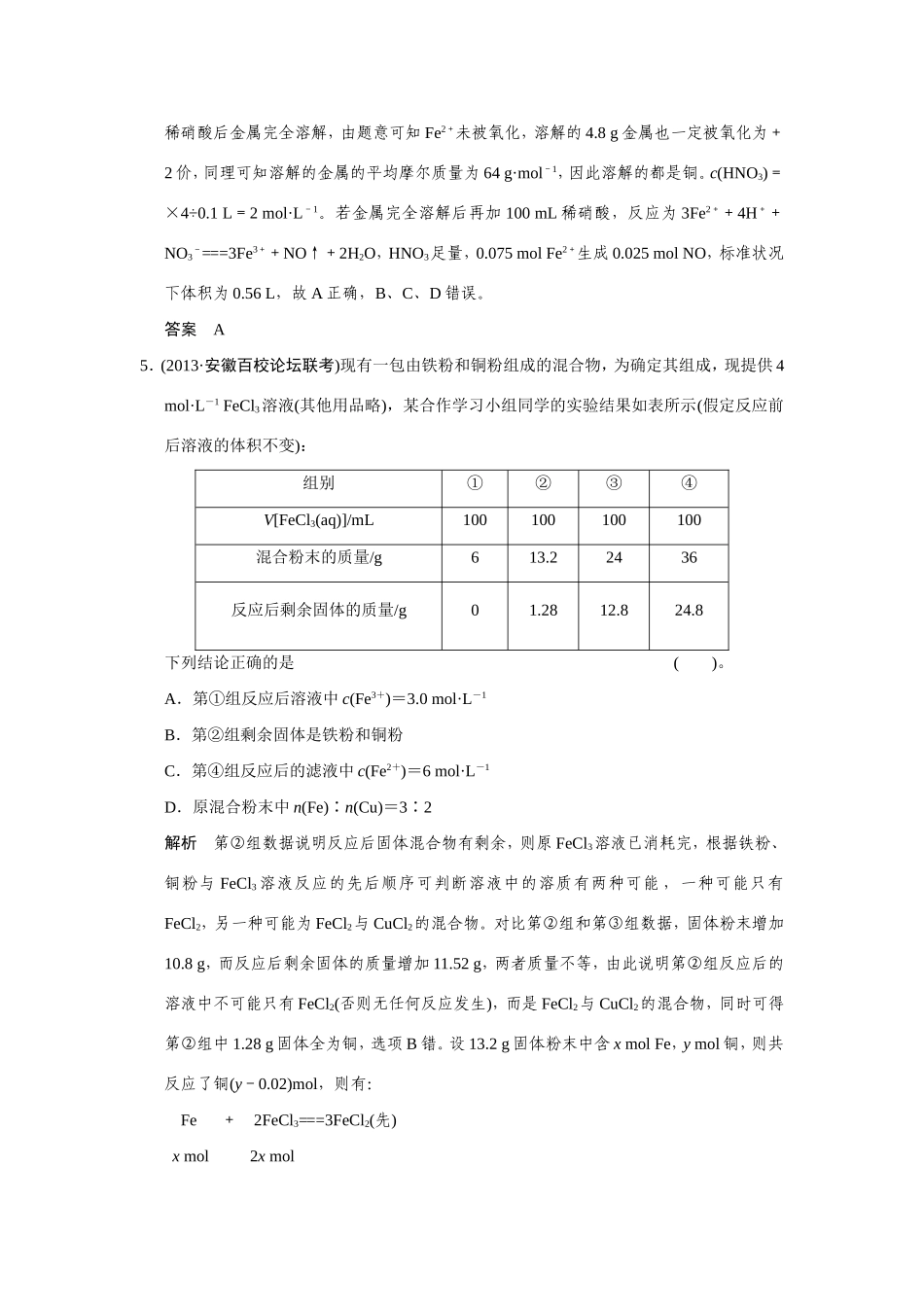
专练十三常见的化学计算方法题型狂练1.向一定量Fe、Fe2O3的混合物中加入250mL2mol·L-1的HNO3溶液,反应完成后生成1.12L(标准状况下)NO气体,再向反应后溶液中加入1mol·L-1NaOH溶液,要使铁元素完全沉淀下来,所加入NaOH溶液体积最少是()。A.450mLB.500mLC.400mLD.不能确定解析此题涉及多个反应,若全部写出化学方程式来计算显得十分繁锁,要使铁元素最终完全沉淀,但不能确定铁元素最终以Fe(OH)3还是Fe(OH)2沉淀,HNO3是否过量也不能确定,因而顺向求解较困难。逆向思维,运用终态法避繁就简,解题思路新颖,求解迅速。要使铁元素完全沉淀,最后的溶液必为NaNO3溶液。由物料守恒有:n(NaOH)=n(NO3-)=n(HNO3)-n(NO),即250×10-3L×2mol·L-1-=1mol·L-1·V(NaOH溶液),V(NaOH溶液)=0.45L=450mL。答案A2.镁铝合金5.1g溶于300mL2mol·L-1盐酸中,标准状况下放出气体体积为5.6L,向反应后的溶液中加入500mLNaOH溶液充分反应,最终产生白色沉淀。下列有关说法不正确的是()。A.5.1g镁铝合金中含有镁、铝的质量分别为2.4g、2.7gB.溶解5.1g镁铝合金时,剩余盐酸的物质的量为0.1molC.生成白色沉淀的最大质量为13.6gD.若白色沉淀只有Mg(OH)2,该NaOH溶液的物质的量浓度至少为1.2mol·L-1解析设5.1g镁铝合金中Mg为xmol,Al为ymol,根据题意知24x+27y=5.1;x+1.5y=5.6/22.4,解得x=y=0.1,反应消耗的盐酸为0.5mol,则剩余HCl的物质的量为0.1mol,A、B两项正确。白色沉淀最多时,m(沉淀)=m[Mg(OH)2]+m[Al(OH)3]=0.1mol×58g·mol-1+0.1mol×78g·mol-1=13.6g。若白色沉淀只有Mg(OH)2,说明Al(OH)3必须完全溶解在NaOH中,NaOH的物质的量最小为0.7mol,其浓度至少为1.4mol·L-1,D项错误。答案D3.(2013·合肥质检)向10gFe2O3、SiO2和Al2O3的混合物中,加入100mLxmol/L稀硫酸,过滤后,向滤液中加入10mol/LNaOH溶液,产生沉淀的质量和加入NaOH溶液体积的关系曲线如图所示。下列叙述错误的是()。A.混合物和稀硫酸反应时,稀硫酸过量B.可求出x的值C.可求出Al2O3的质量分数D.可求出Fe2O3的质量分数解析由于SiO2不溶于稀硫酸,因此滤渣为SiO2。向滤液中加入NaOH溶液时,开始时无沉淀生成,说明稀硫酸过量,A正确。当沉淀的质量达到最大时,溶液中的溶质为Na2SO4,由此可得x=5,B正确。根据图像可知溶解Al(OH)3时消耗NaOH的物质的量为0.1mol,则原混合物中n(Al2O3)为0.05mol,由此可得Al2O3的质量分数为51%,C正确。由于图像中未给出向混合溶液中加入NaOH溶液时,过量的酸消耗NaOH的量,因此无法求出混合物中Fe2O3的质量分数,D错。答案D4.(2013·安徽江南十校第二次联考,13)将9g铜和铁的混合物投入到100mL稀硝酸中,充分反应后得到标准状况下1.12LNO,剩余4.8g金属;继续加入100mL等浓度的稀硝酸,金属完全溶解,又得到标准状况下1.12LNO。若向反应后的溶液中加入KSCN溶液,溶液不变红,则下列说法正确的是()。A.原混合物中铜和铁各0.075molB.稀硝酸的物质的量浓度为0.5mol·L-1C.第一次剩余4.8g金属为铜和铁D.再加入上述100mL稀硝酸,又得到标准状况下1.12LNO解析本题以金属和稀硝酸的反应为背景,考查了守恒定律在计算题中的应用。第一次加稀硝酸时金属有剩余,溶解的4.2g金属均被氧化为+2价,溶解金属的物质的量为×3×=0.075mol,金属的平均摩尔质量为==56g·mol-1,因此溶解的都是铁;第二次加稀硝酸后金属完全溶解,由题意可知Fe2+未被氧化,溶解的4.8g金属也一定被氧化为+2价,同理可知溶解的金属的平均摩尔质量为64g·mol-1,因此溶解的都是铜。c(HNO3)=×4÷0.1L=2mol·L-1。若金属完全溶解后再加100mL稀硝酸,反应为3Fe2++4H++NO3-===3Fe3++NO↑+2H2O,HNO3足量,0.075molFe2+生成0.025molNO,标准状况下体积为0.56L,故A正确,B、C、D错误。答案A5.(2013·安徽百校论坛联考)现有一包由铁粉和铜粉组成的混合物,为确定其组成,现提供4mol·L-1FeCl3溶液(其他用品略),某合作学习小组同学的实验结果如表所示(假定反应前后溶液的体积不变):组别①②③④V[FeCl3(aq)]/mL100100100100混合粉末的质量/g613.22436反...