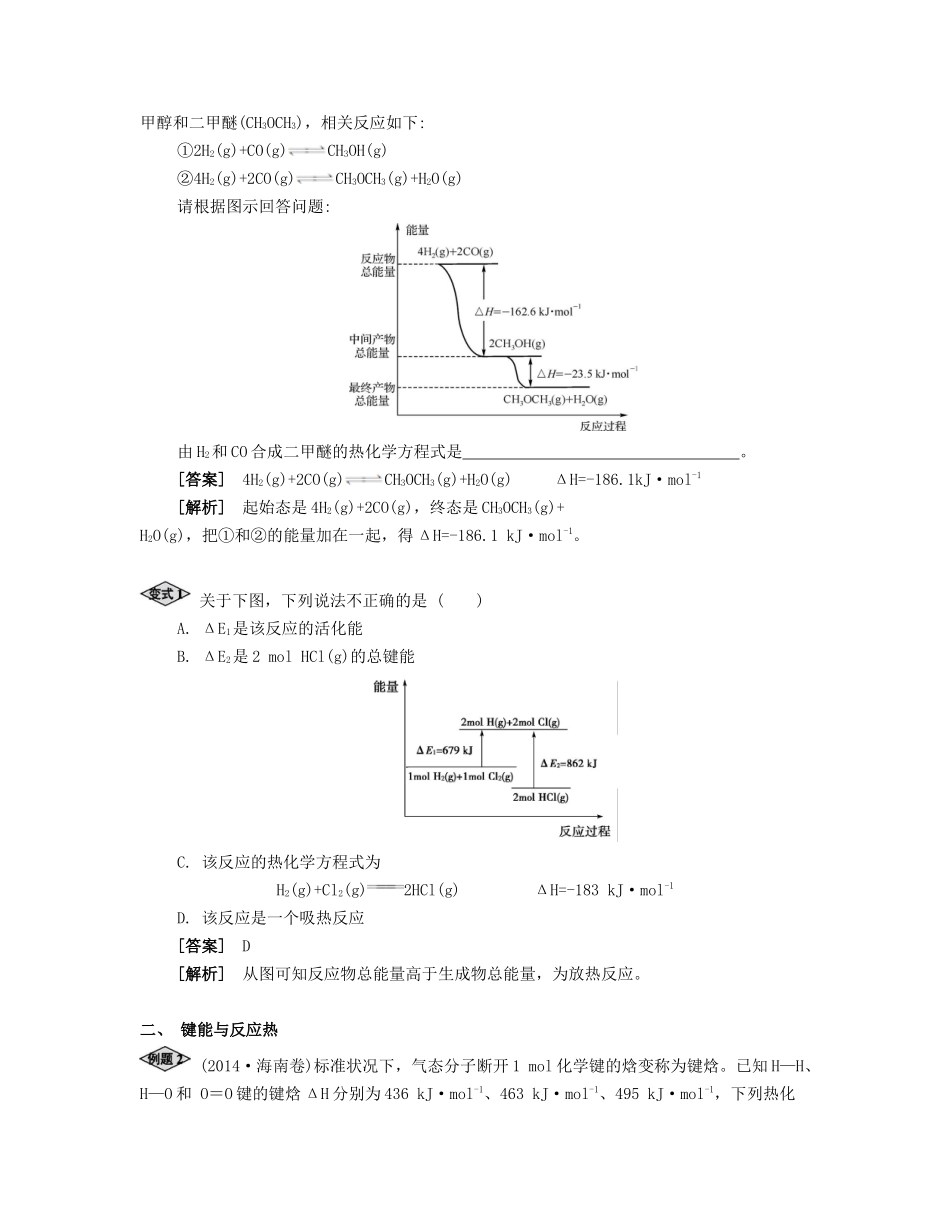
课时21反应热盖斯定律夯实基础考点过关反应热与热化学方程式【基础梳理】1.反应热在一定温度下,当一个化学反应进行时,反应释放或吸收的热量称为此反应在该温度下的反应热。反应热用符号ΔH表示,单位一般采用。放热反应ΔH0,吸热反应ΔH0。(1)反应热的大小与参加反应的物质的多少有关,也与参加反应的物质状态和生成物状态有关,而与反应的途径。(2)反应热的分析与计算①从物质的能量角度分析反应热化学反应伴有能量变化ΔH=∑E(的总能量)-∑E(的总能量)②从键能的角度分析反应热注意:计算物质中键的个数时,不能忽略物质的结构。如:①1mol晶体硅中含2molSi—Si键;②1molSiO2中含4molSi—O键。2.热化学方程式表示反应所放出或吸收热量的化学方程式,叫做热化学方程式。热化学方程式的书写要注意以下几点:(1)ΔH只能写在标有反应物和生成物状态的化学方程式的右边。(2)绝大多数ΔH是在25℃、101325Pa下测定的,书写热化学方程式时可不注明温度和压强。(3)注意热化学方程式中各物质化学式前面的化学计量数仅表示该物质的物质的量,并不表示物质的分子或原子数。因此化学计量数可以是整数,也可以是分数。(4)注意反应物和产物的聚集状态不同,反应热数值以及符号都可能不同。因此,必须注明物质的聚集状态(s、l、g)才能完整地体现出热化学方程式的意义。热化学方程式中不用“↑”和“↓”。(5)注意热化学方程式是表示反应已完成的数量。ΔH与反应完成物质的量有关,所以热化学方程式中化学式前面的化学计量数必须与ΔH相对应。如果化学计量数加倍,则ΔH也要:EE:EE反生反生放热反应吸热反应加倍。H2(g)+O2(g)H2O(l)ΔH=-285.8kJ·mol-12H2(g)+O2(g)2H2O(l)ΔH=kJ·mol-1(6)反应的可逆性:当反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。不论化学反应是否可逆,热化学方程式中的ΔH都表示反应进行到底(完全转化)时的反应热。如2SO2(g)+O2(g)2SO3(g)ΔH=-197kJ·mol-1,是指2molSO2(g)与1molO2(g)放于一密闭容器中完全转化为2molSO3时放出的热量。若在相同的温度和压强时,向容器中加2molSO2(g)和1molO2(g),一定条件下反应达平衡时,放出的热量要197kJ。微课1吸热反应和放热反应的比较类型比较吸热反应放热反应定义吸收热量的化学反应放出热量的化学反应表示方法ΔH>0ΔH<0图示实例①所有的水解反应②所有的电离过程③大多数的分解反应④Ba(OH)2·8H2O(s)+2NH4Cl(s)BaCl2(aq)+2NH3(g)+10H2O(l)⑤C(s)+CO2(g)2CO(g)⑥C+H2O(g)CO+H2⑦植物的光合作用①所有的燃烧反应②所有的酸、碱中和反应③合成氨反应④大多数的化合反应,如生石灰和水的反应、合成氨反应等⑤金属与酸,活泼金属与水的反应等大多数的置换反应【典型例题】一、化学反应能量图“生物质”是指由植物或动物生命体衍生得到的物质的总称。“生物质能”是人类解决能源危机的一种重要的能源。“生物质”在一定条件下可气化为CO、H2等原料气,进而合成12甲醇和二甲醚(CH3OCH3),相关反应如下:①2H2(g)+CO(g)CH3OH(g)②4H2(g)+2CO(g)CH3OCH3(g)+H2O(g)请根据图示回答问题:由H2和CO合成二甲醚的热化学方程式是。[答案]4H2(g)+2CO(g)CH3OCH3(g)+H2O(g)ΔH=-186.1kJ·mol-1[解析]起始态是4H2(g)+2CO(g),终态是CH3OCH3(g)+H2O(g),把①和②的能量加在一起,得ΔH=-186.1kJ·mol-1。关于下图,下列说法不正确的是()A.ΔE1是该反应的活化能B.ΔE2是2molHCl(g)的总键能C.该反应的热化学方程式为H2(g)+Cl2(g)2HCl(g)ΔH=-183kJ·mol-1D.该反应是一个吸热反应[答案]D[解析]从图可知反应物总能量高于生成物总能量,为放热反应。二、键能与反应热(2014·海南卷)标准状况下,气态分子断开1mol化学键的焓变称为键焓。已知H—H、H—O和O=O键的键焓ΔH分别为436kJ·mol-1、463kJ·mol-1、495kJ·mol-1,下列热化学方程式正确的是()A.H2O(g)H2(g)+O2(g)ΔH=—485kJ·mol-1B.H2O(g)H2(g)+O2(g)ΔH=+485kJ·mol-1C.2H2(g)+O2(g)2H2O(g)ΔH=+485kJ·mol-1D.2H2(g)+O2(g)2H2O(g)ΔH=—485kJ·mol-1[答案]D[解析]根据“H—H、H—O和O=O键的键焓ΔH分别为436kJ·mol-1、463kJ·mol-1、495kJ·mol-1”,可以计算出2molH2...