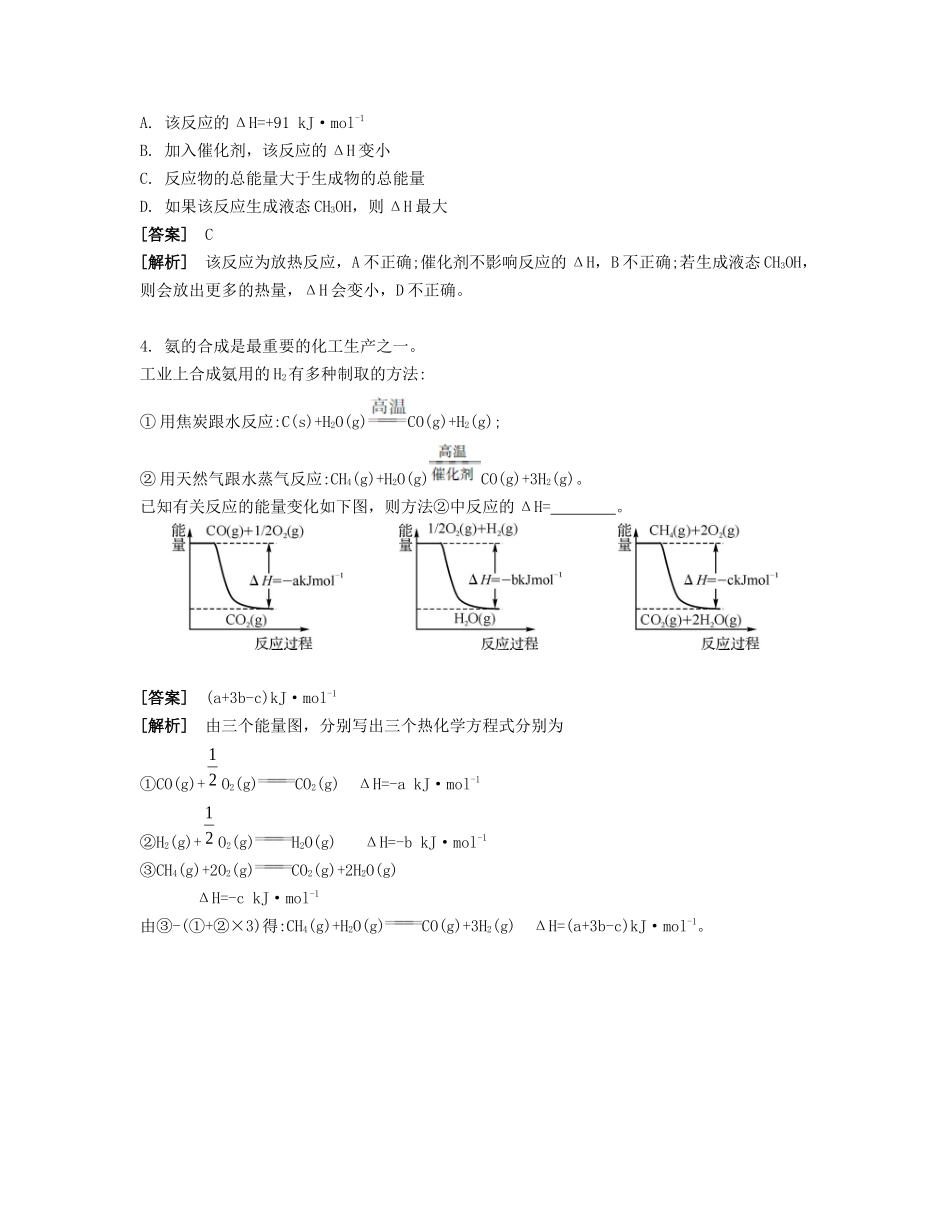
课时21反应热盖斯定律能力摸底课前热身1.(2014·各地模拟组合)(1)已知在常温常压下:①2CH3OH(l)+3O2(g)2CO2(g)+4H2O(g)ΔH1②2CO(g)+O2(g)2CO2(g)ΔH2则1mol甲醇不完全燃烧生成一氧化碳和气态水时反应的ΔH=(用含ΔH1、ΔH2的式子表示)。(2)CH3OH作为内燃机燃料或通过燃料电池驱动车辆,可减少CO2排放多达45%。已知:CH3OH(g)+H2O(g)CO2(g)+3H2(g)ΔH1=+49.0kJ·mol-12H2(g)+O2(g)2H2O(g)ΔH2=-483.6kJ·mol-1则反应CH3OH(g)+O2(g)CO2(g)+2H2(g)的ΔH=kJ·mol-1。(3)工业上可用煤制天然气,生产过程中有多种途径生成CH4。写出CO2与H2反应生成CH4和H2O的热化学方程式:。已知:①CO(g)+H2O(g)H2(g)+CO2(g)ΔH=-41kJ·mol-1②C(s)+2H2(g)CH4(g)ΔH=-73kJ·mol-1③2CO(g)C(s)+CO2(g)ΔH=-171kJ·mol-1(4)已知:4Al(s)+3O2(g)2Al2O3(s)ΔH=-2834.9kJ·mol-1Fe2O3(s)+C(s)CO2(g)+2Fe(s)ΔH=+234.1kJ·mol-1C(s)+O2(g)CO2(g)ΔH=-393.5kJ·mol-1写出铝与氧化铁发生铝热反应的热化学方程式:。[答案](1)(2)-192.8(3)CO2(g)+4H2(g)CH4(g)+2H2O(g)12323212ΔH-ΔH2ΔH=-162kJ·mol-1(4)2Al(s)+Fe2O3(s)Al2O3(s)+2Fe(s)ΔH=-593.1kJ·mol-1[解析](1)①式-②式后再除以2。(2)根据盖斯定律,第一个热化学方程式+第二个热化学方程式×2可得出答案。(3)根据盖斯定律,得出关系式:②-2×①+③。(4)①4Al(s)+3O2(g)2Al2O3(s)ΔH=-2834.9kJ·mol-1②Fe2O3(s)+C(s)CO2(g)+2Fe(s)ΔH=+234.1kJ·mol-1③C(s)+O2(g)CO2(g)ΔH=-393.5kJ·mol-1④2Al(s)+Fe2O3(s)Al2O3(s)+2Fe(s)ΔH由盖斯定律可得出关系式:④=+②-×③。2.(2014·重庆卷)已知:C(s)+H2O(g)CO(g)+H2(g)ΔH=akJ·mol-12C(s)+O2(g)2CO(g)ΔH=-220kJ·mol-1H—H、O=O和O—H键的键能分别为436、496和462kJ·mol-1,则a为()A.-332B.-118C.+350D.+130[答案]D[解析]设两个热化学方程式分别为①②,根据盖斯定律②-①×2得:2H2(g)+O2(g)2H2O(g)ΔH=-(220+2a)kJ·mol-1则有:2×436+496-4×462=-(220+2a),则a=+130,答案选D。3.(2014·陕西西安中学三检)已知CO(g)+2H2(g)CH3OH(g)的能量变化情况如下图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是()32322①32A.该反应的ΔH=+91kJ·mol-1B.加入催化剂,该反应的ΔH变小C.反应物的总能量大于生成物的总能量D.如果该反应生成液态CH3OH,则ΔH最大[答案]C[解析]该反应为放热反应,A不正确;催化剂不影响反应的ΔH,B不正确;若生成液态CH3OH,则会放出更多的热量,ΔH会变小,D不正确。4.氨的合成是最重要的化工生产之一。工业上合成氨用的H2有多种制取的方法:①用焦炭跟水反应:C(s)+H2O(g)CO(g)+H2(g);②用天然气跟水蒸气反应:CH4(g)+H2O(g)CO(g)+3H2(g)。已知有关反应的能量变化如下图,则方法②中反应的ΔH=。[答案](a+3b-c)kJ·mol-1[解析]由三个能量图,分别写出三个热化学方程式分别为①CO(g)+O2(g)CO2(g)ΔH=-akJ·mol-1②H2(g)+O2(g)H2O(g)ΔH=-bkJ·mol-1③CH4(g)+2O2(g)CO2(g)+2H2O(g)ΔH=-ckJ·mol-1由③-(①+②×3)得:CH4(g)+H2O(g)CO(g)+3H2(g)ΔH=(a+3b-c)kJ·mol-1。1212