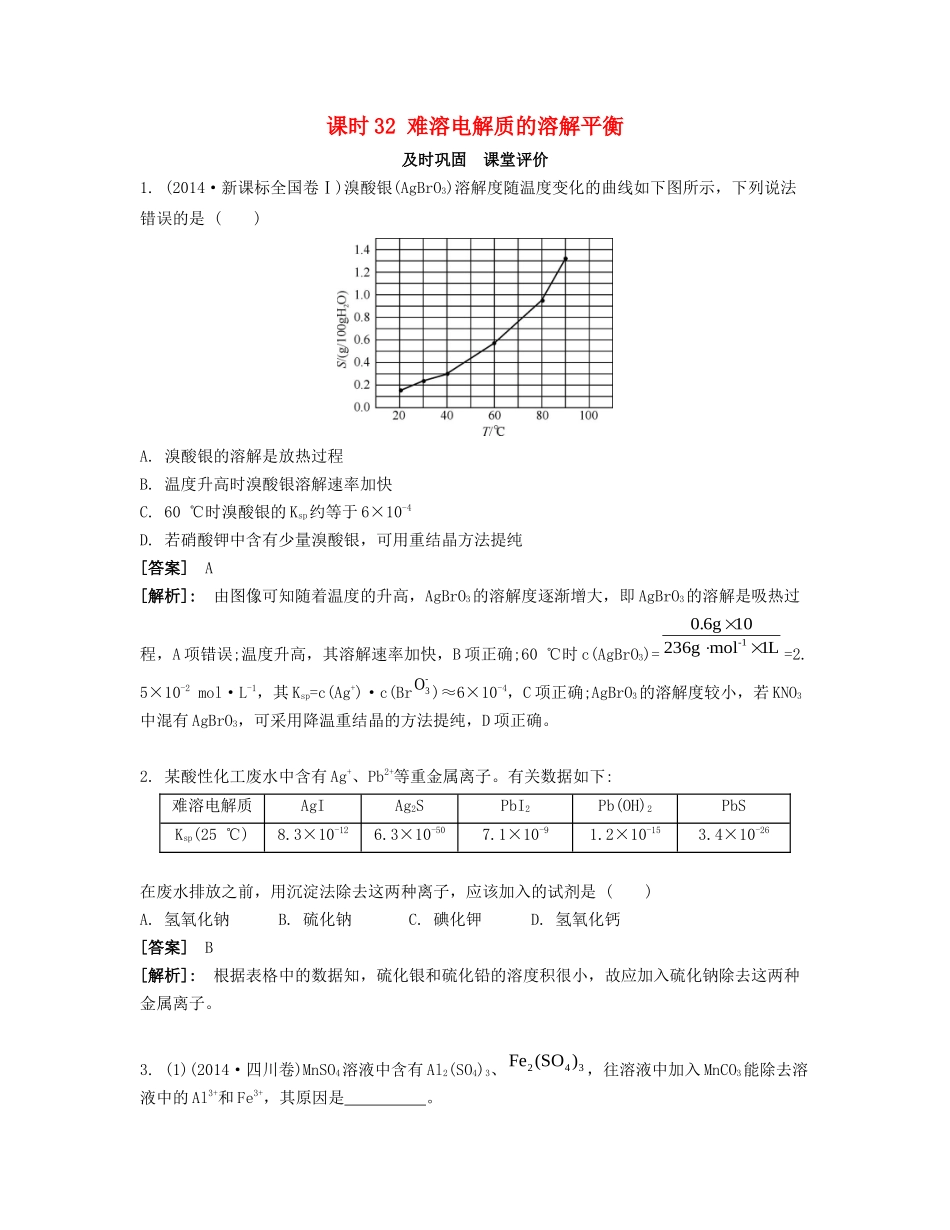
课时32难溶电解质的溶解平衡及时巩固课堂评价1.(2014·新课标全国卷Ⅰ)溴酸银(AgBrO3)溶解度随温度变化的曲线如下图所示,下列说法错误的是()A.溴酸银的溶解是放热过程B.温度升高时溴酸银溶解速率加快C.60℃时溴酸银的Ksp约等于6×10-4D.若硝酸钾中含有少量溴酸银,可用重结晶方法提纯[答案]A[解析]:由图像可知随着温度的升高,AgBrO3的溶解度逐渐增大,即AgBrO3的溶解是吸热过程,A项错误;温度升高,其溶解速率加快,B项正确;60℃时c(AgBrO3)==2.5×10-2mol·L-1,其Ksp=c(Ag+)·c(Br)≈6×10-4,C项正确;AgBrO3的溶解度较小,若KNO3中混有AgBrO3,可采用降温重结晶的方法提纯,D项正确。2.某酸性化工废水中含有Ag+、Pb2+等重金属离子。有关数据如下:难溶电解质AgIAg2SPbI2Pb(OH)2PbSKsp(25℃)8.3×10-126.3×10-507.1×10-91.2×10-153.4×10-26在废水排放之前,用沉淀法除去这两种离子,应该加入的试剂是()A.氢氧化钠B.硫化钠C.碘化钾D.氢氧化钙[答案]B[解析]:根据表格中的数据知,硫化银和硫化铅的溶度积很小,故应加入硫化钠除去这两种金属离子。3.(1)(2014·四川卷)MnSO4溶液中含有Al2(SO4)3、,往溶液中加入MnCO3能除去溶液中的Al3+和Fe3+,其原因是。-10.6g10236gmol1L-3O243Fe(SO)(2)已知室温下BaSO4的Ksp=1.1×10-10,欲使溶液中c(S)≤1.0×10-6mol·L-1,应保持溶液中c(Ba2+)≥mol·L-1。(3)已知常温下Mg(OH)2的Ksp=1.8×10-11,若溶液中c(OH-)=3.0×10-6mol·L-1,则溶液中c(Mg2+)=。[答案](1)消耗溶液中的酸,促进Al3+和Fe3+水解生成氢氧化物沉淀(2)1.1×10-4(3)2.0mol·L-1[解析]:(1)加入MnCO3消耗溶液中的H+,促使Al3+和Fe3+的水解平衡正向移动,生成氢氧化物沉淀除去。(2)因为Ksp=c(Ba2+)·c(S)=1.1×10-10,而溶液中c(S)最大值=1.0×10-6mol·L-1,所以c(Ba2+)===1.1×10-4mol·L-1,c(Ba2+)最小值是1.1×10-4mol·L-1。(3)因为Ksp=c(Mg2+)·c2(OH-)=1.8×10-11,而溶液中c(OH-)=3.0×10-6mol·L-1,所以c(Mg2+)===2.0mol·L-1。4.(1)铬是严重的致癌物质,绝不允许含铬废水随意排放。一种治理含Cr2酸性工业废水的方法是向废水中加入适量的食盐,用铁作电极进行电解,Cr2被还原为Cr3+,然后生成Cr(OH)3沉淀除去,以达到排放标准。已知电解后溶液中c(Fe3+)为4.0×10-13mol·L-1,则溶液中c(Cr3+)浓度为。(已知Ksp[Fe(OH)3]=4.0×10-38;Ksp[Cr(OH)3]=6.0×10-31)(2)已知常温下Ksp[Fe(OH)3]=1.25×10-36,则溶液中加入KOH溶液到pH=时Fe3+才能完全沉淀(当溶液中某种离子浓度小于10-5mol·L-1时可看作完全沉淀,lg2=0.3,lg5=0.7)。常温下反应Fe3++3H2OFe(OH)3+3H+的平衡常数K=[水解生成的Fe(OH)3为胶体,其浓度不代入计算式,写出计算结果]。(3)AgCl的悬浊液中加入Na2S溶液,白色沉淀转化为黑色沉淀,其原因是。[答案](1)6.0×10-6mol·L-1(2)3.78×10-7(3)Ag2S沉淀比AgCl更难溶[解析]:(1)Ksp[Fe(OH)3]=c(Fe3+)·c3(OH-)=4.0×10-38,现在c(Fe3+)为4.0×10-13mol·L-1,此时)===1.0×10-25,同时]=c(Cr3+)·c3(OH-)=6.0×10-31,现在c3(OH-)=1.0×10-25,c(Cr3+)===6.0×10-6mol·L-1。(2)Fe3+要完全沉淀浓度必须小于10-5mol·L-1,即c(Fe3+)=1.0×10-5mol·L-1,Ksp[Fe(OH)3]=2-4O2-4O2-4Osp2-4Kc(SO)-10-61.1101.010sp2-Kc(OH)-11-621.810(3.010)2-7O2-7O33Fe(NO)3-c(OHsp3Kc(Fe)-38-134.0104.010sp3K[Cr(OH)sp3-Kc(OH)-31-256.0101.010c(Fe3+)·c3(OH-)=1.25×10-36,此时c3(OH-)===1.25×10-31,c(OH-)=5×10-11mol·L-1,c(H+)===2.0×10-4mol·L-1,pH=4-lg2=3.7。Fe3++3H2OFe(OH)3+3H+的平衡常数K=====8×10-7。(3)这是一个沉淀的转化过程,由难溶电解质转变为更难溶电解质,Ag2S沉淀比AgCl更难溶。【参考答案】问题思考问题1:Ksp只与温度有关。问题2:不一定;由难溶的沉淀转化为更易溶的沉淀是比较难以实现的一种转化,但并不是不能实现,前提是“两种沉淀的溶解度相差不是很大”。虽然Ksp(BaSO4)(2)<(3)=2.(1)平衡常数Ksp(2)cm(An+)·cn(Bm-)(3)温度温度考点2:1.Cu(OH)2(或CuO)2.稀盐酸(或稀硫酸)3.白AgCl黄AgI黑Ag2Ssp3Kc(Fe)-36-51.25101.010w-Kc(OH)-14-111.01051033c(H)c(Fe)33-33-c(H)c(OH)c(Fe)c(OH)3wsp3(K)K[Fe(OH)]-143-36(1.010)1.2510