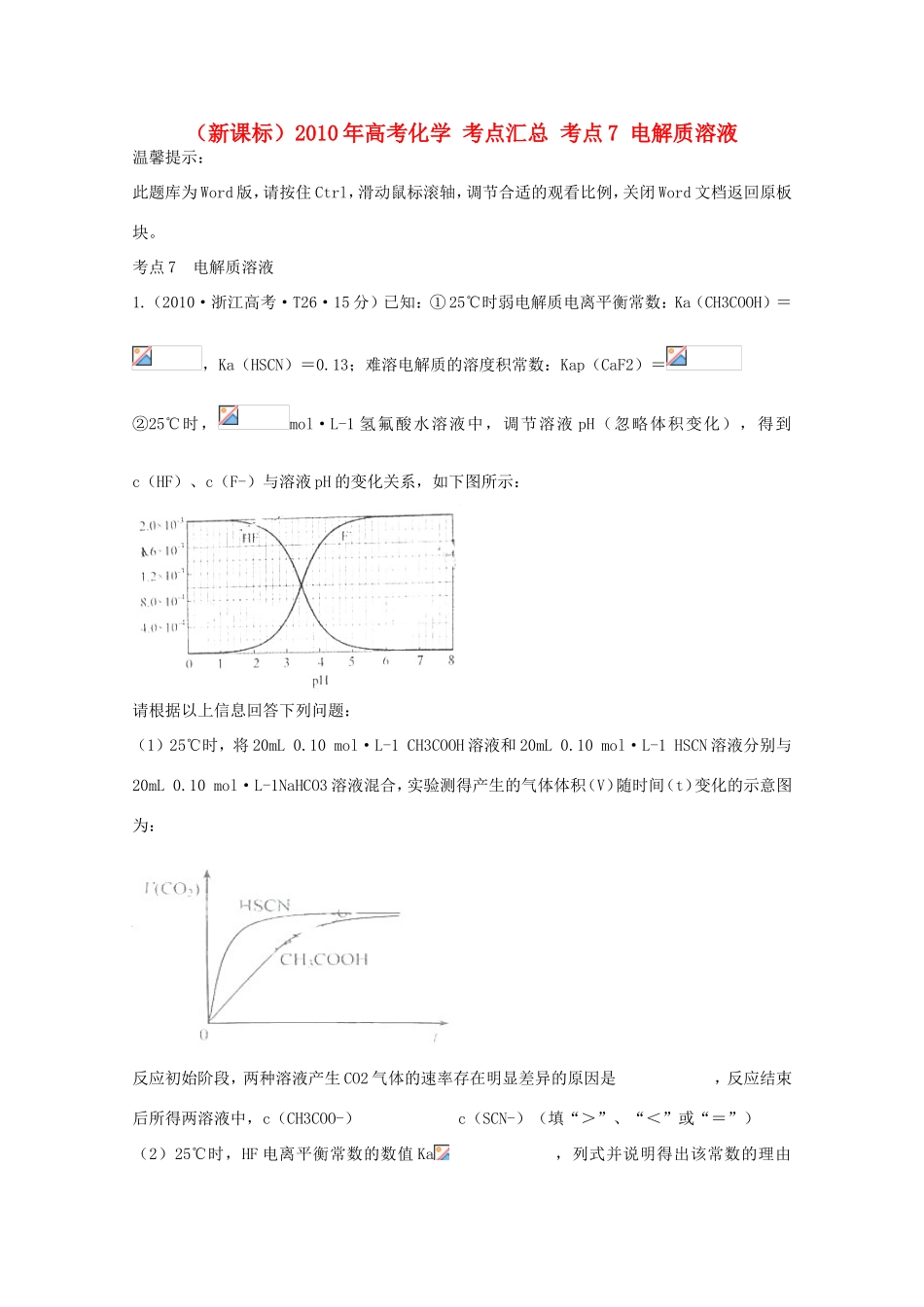
(新课标)2010年高考化学考点汇总考点7电解质溶液温馨提示:此题库为Word版,请按住Ctrl,滑动鼠标滚轴,调节合适的观看比例,关闭Word文档返回原板块。考点7电解质溶液1.(2010·浙江高考·T26·15分)已知:①25℃时弱电解质电离平衡常数:Ka(CH3COOH)=,Ka(HSCN)=0.13;难溶电解质的溶度积常数:Kap(CaF2)=②25℃时,mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示:请根据以上信息回答下列问题:(1)25℃时,将20mL0.10mol·L-1CH3COOH溶液和20mL0.10mol·L-1HSCN溶液分别与20mL0.10mol·L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图为:反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是,反应结束后所得两溶液中,c(CH3COO-)c(SCN-)(填“>”、“<”或“=”)(2)25℃时,HF电离平衡常数的数值Ka,列式并说明得出该常数的理由。(3)mol·L-1HF溶液与mol·L-1CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生。【命题立意】本题主要考查弱电解质的电离平衡和难溶电解质的沉淀溶解平衡,侧重考查学生分析问题、解决问题的能力。【思路点拨】解答本题应先理解Ka及Kap的意义,然后依据Ka及Kap的表达式进行计算。【规范解答】(1)由Ka(CH3COOH)、Ka(HSCN)的数据知,HSCN的酸性比CH3COOH强,其溶液中c(H+)大,所以其溶液与NaHCO3溶液反应的速率快。反应结束后所得两溶液分别为CH3COONa溶液和NaSCN溶液,由于HSCN的酸性比CH3COOH强,则SCN-的水解程度比CH3COO-弱,所以c(CH3COO-)