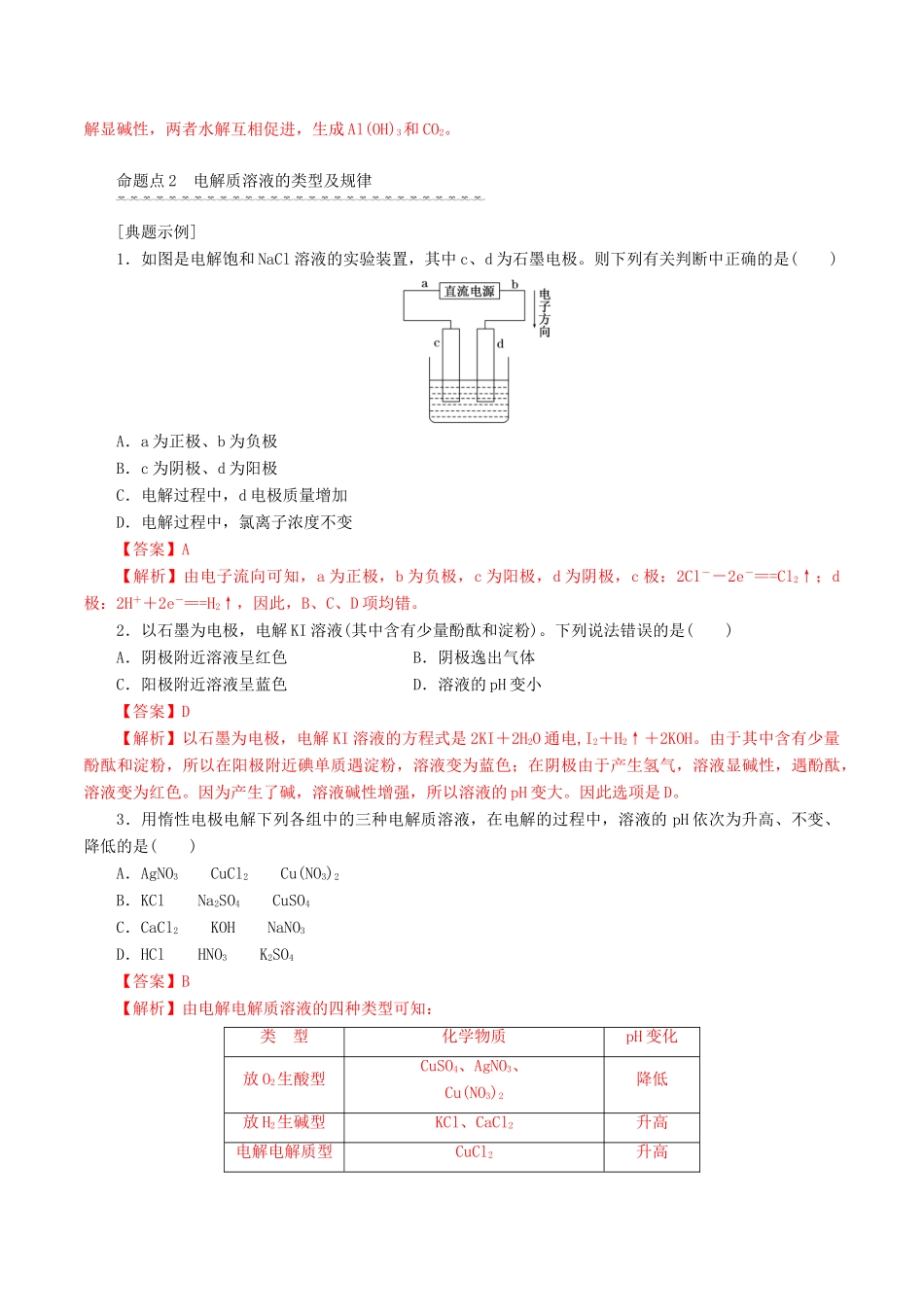
第3讲电解池金属的电化学腐蚀与防护考纲要求:1.了解电解池的工作原理。2.能写出电极反应式和电解反应方程式。3.理解金属发生电化学腐蚀的原因,金属腐蚀的危害,防止金属腐蚀的措施。考点一电解原理[教材知识层面]1.电解使电流通过电解质溶液(或熔融的电解质)而在阴、阳两极引起氧化还原反应的过程。2.电解池(也叫电解槽)(1)概念:电解池是把电能转变为化学能的装置。(2)构成条件:①有与电源相连的两个电极。②电解质溶液(或熔融盐)。③形成闭合回路。(3)电极名称及电极反应式(如图):总反应方程式:Cu2++2Cl-=====Cu+Cl2↑(4)电子和离子移动方向:①电子:从电源负极流向电解池的阴极;从电解池的阳极流向电源的正极。②离子:阳离子移向电解池的阴极;阴离子移向电解池的阳极。[高考考查层面]命题点1电解方程式的书写1.方法步骤(1)首先判断阴、阳极,分析阳极材料是惰性电极还是活泼电极。(2)再分析电解质水溶液的组成,找全离子并分阴、阳两组(勿忘水溶液中的H+和OH-)。(3)然后排出阴、阳两极的放电顺序。阴极:阳离子放电顺序:Ag+>Fe3+>Cu2+>H+(酸)>Fe2+>Zn2+>H+(水)>Al3+>Mg2+>Na+>Ca2+>K+(水溶液中Al3+、Mg2+、Na+、Ca2+、K+不放电)。阳极:活泼电极>S2->I->Br->Cl->OH->含氧酸根离子(水溶液中含氧酸根离子不放电)。(4)分析电极反应,判断电极产物,写出电极反应式,要注意遵循原子守恒和电荷守恒。(5)最后写出电解反应的总化学方程式或离子方程式。2.注意问题(1)书写电解池中电极反应式时,要以实际放电的离子表示,但书写总电解反应方程式时,弱电解质要写成分子式。(2)要确保两极电子转移数目相同,且注明条件“电解”。(3)注意题目信息中提示的离子的放电,如电解法制取KMnO4等。[典题示例]1.按要求书写有关的电极反应式及总方程式。(1)用惰性电极电解AgNO3溶液:阳极反应式:___________________________________________________________;阴极反应式:___________________________________________________________;总反应离子方程式:_____________________________________________________。(2)用惰性电极电解MgCl2溶液阳极反应式:___________________________________________________________;阴极反应式:___________________________________________________________;总反应离子方程式:_____________________________________________________。(3)用铁作电极电解NaCl溶液阳极反应式:___________________________________________________________;阴极反应式:___________________________________________________________;总化学方程式:_________________________________________________________。(4)用铜作电极电解盐酸溶液阳极反应式:__________________________________________________________;阴极反应式:___________________________________________________________;总反应离子方程式:_____________________________________________________。【答案】(1)4OH--4e-===O2↑+2H2O4Ag++4e-===4Ag4Ag++2H2O=====4Ag+O2↑+4H+(2)2Cl--2e-===Cl2↑2H++2e-===H2↑Mg2++2Cl-+2H2O=====Mg(OH)2↓+Cl2↑+H2↑(3)Fe-2e-===Fe2+2H++2e-===H2↑Fe+2H2O=====Fe(OH)2↓+H2↑(4)Cu-2e-===Cu2+2H++2e-===H2↑Cu+2H+=====Cu2++H2↑2.Ⅰ.以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极电极反应式为_________________。Ⅱ.用Al单质作阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成难溶物R,R受热分解生成化合物Q。写出阳极生成R的电极反应式:____________________________________。【答案】Ⅰ.2Al-6e-+3H2O===Al2O3+6H+Ⅱ.Al+3HCO-3e-===Al(OH)3+3CO2↑【解析】Ⅰ.依据信息阳极形成的氧化膜一定为Al2O3,Al失电子生成Al2O3,Al2O3中的氧是由水提供的,溶液显酸性,所以有H+生成;Ⅱ.Al作阳极,失电子,生成Al3+,Al3+水解显酸性,溶液中的HCO水解显碱性,两者水解互相促进,生成Al(OH)3和CO2。命题点2电解质溶液的类型及规律[典题...