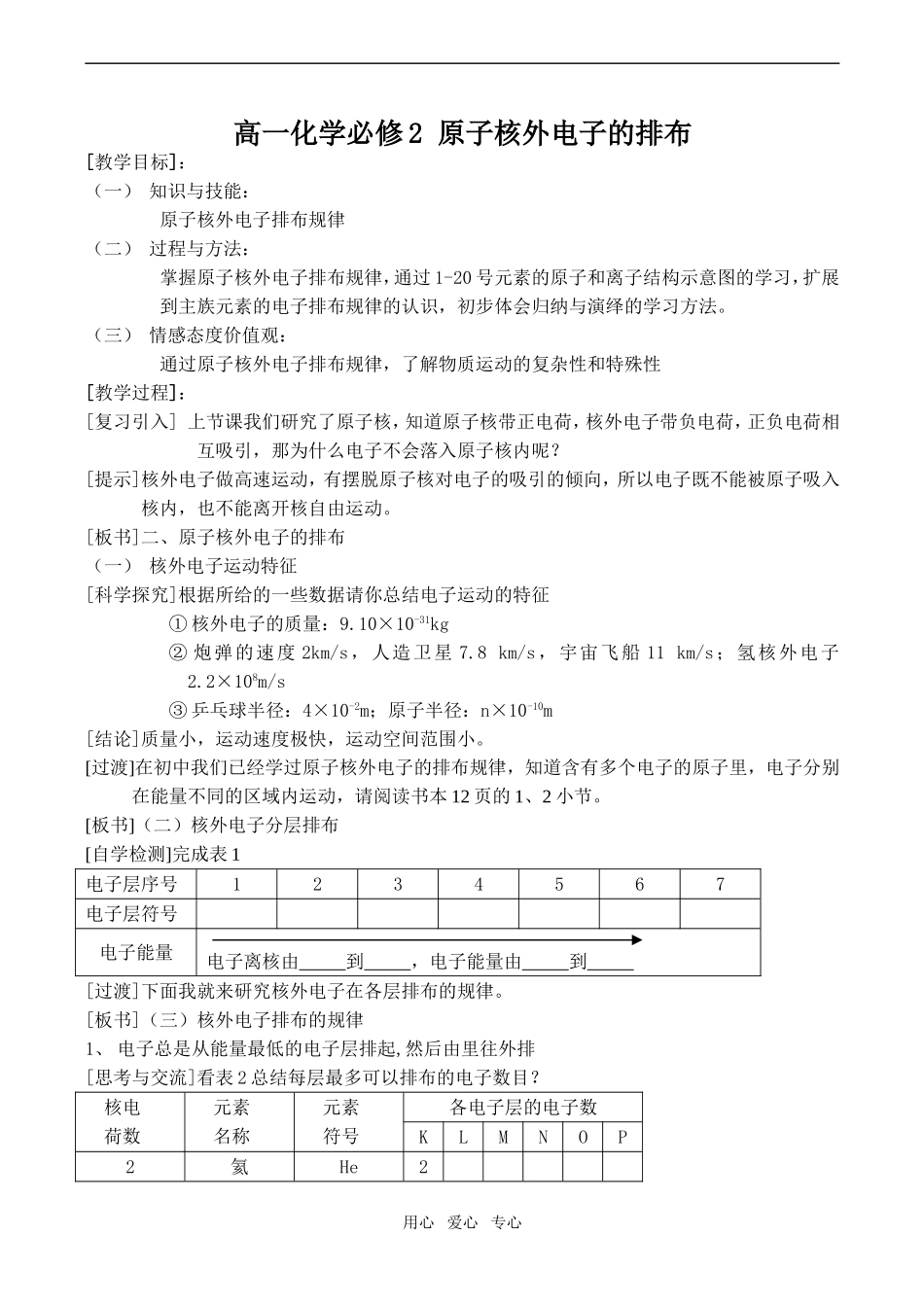
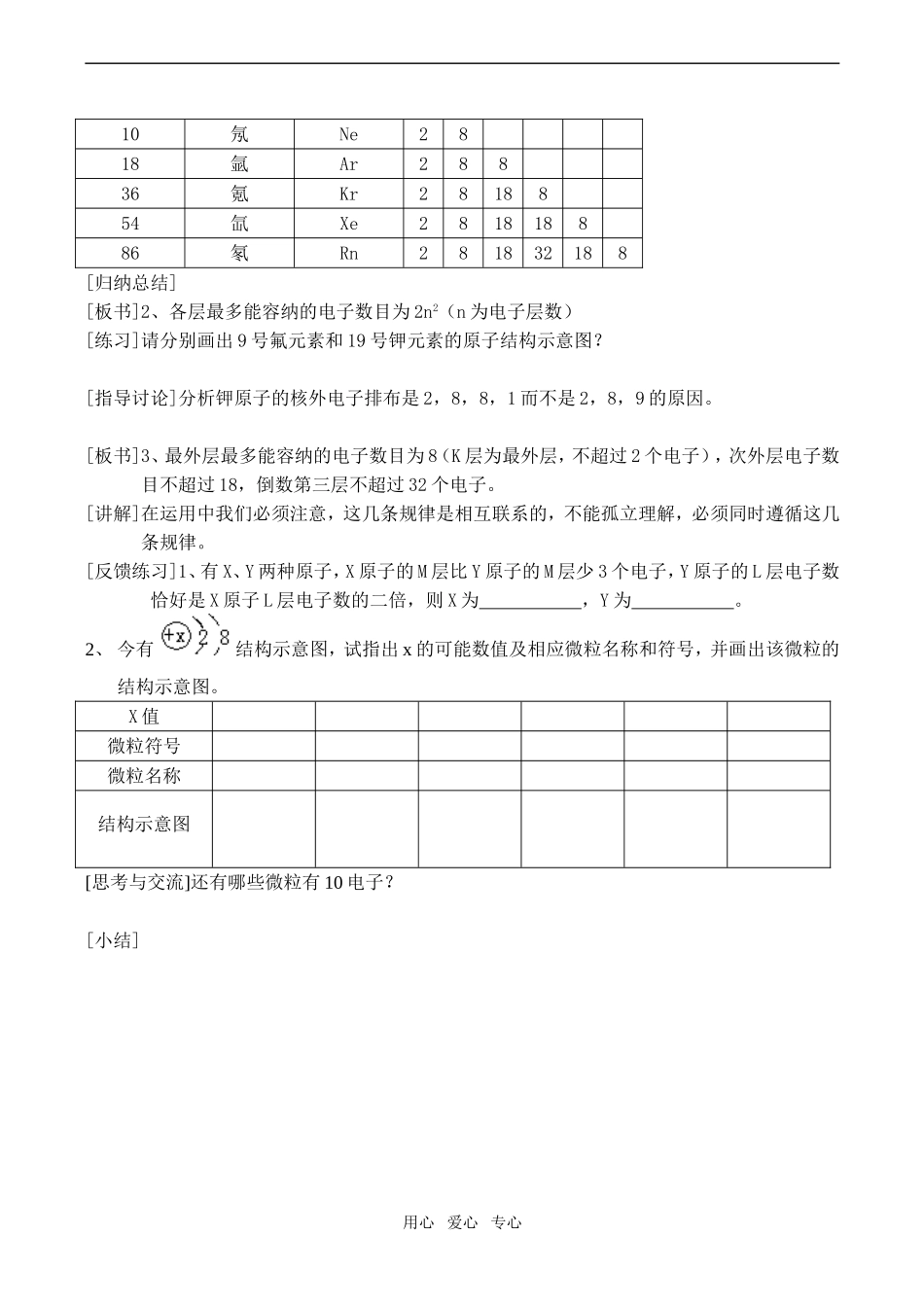
高一化学必修2原子核外电子的排布[教学目标]:(一)知识与技能:原子核外电子排布规律(二)过程与方法:掌握原子核外电子排布规律,通过1-20号元素的原子和离子结构示意图的学习,扩展到主族元素的电子排布规律的认识,初步体会归纳与演绎的学习方法。(三)情感态度价值观:通过原子核外电子排布规律,了解物质运动的复杂性和特殊性[教学过程]:[复习引入]上节课我们研究了原子核,知道原子核带正电荷,核外电子带负电荷,正负电荷相互吸引,那为什么电子不会落入原子核内呢?[提示]核外电子做高速运动,有摆脱原子核对电子的吸引的倾向,所以电子既不能被原子吸入核内,也不能离开核自由运动。[板书]二、原子核外电子的排布(一)核外电子运动特征[科学探究]根据所给的一些数据请你总结电子运动的特征①核外电子的质量:9.10×10-31kg②炮弹的速度2km/s,人造卫星7.8km/s,宇宙飞船11km/s;氢核外电子2.2×108m/s③乒乓球半径:4×10-2m;原子半径:n×10-10m[结论]质量小,运动速度极快,运动空间范围小。[过渡]在初中我们已经学过原子核外电子的排布规律,知道含有多个电子的原子里,电子分别在能量不同的区域内运动,请阅读书本12页的1、2小节。[板书](二)核外电子分层排布[自学检测]完成表1电子层序号1234567电子层符号电子能量电子离核由到,电子能量由到[过渡]下面我就来研究核外电子在各层排布的规律。[板书](三)核外电子排布的规律1、电子总是从能量最低的电子层排起,然后由里往外排[思考与交流]看表2总结每层最多可以排布的电子数目?核电荷数元素名称元素符号各电子层的电子数KLMNOP2氦He2用心爱心专心10氖Ne2818氩Ar28836氪Kr2818854氙Xe281818886氡Rn281832188[归纳总结][板书]2、各层最多能容纳的电子数目为2n2(n为电子层数)[练习]请分别画出9号氟元素和19号钾元素的原子结构示意图?[指导讨论]分析钾原子的核外电子排布是2,8,8,1而不是2,8,9的原因。[板书]3、最外层最多能容纳的电子数目为8(K层为最外层,不超过2个电子),次外层电子数目不超过18,倒数第三层不超过32个电子。[讲解]在运用中我们必须注意,这几条规律是相互联系的,不能孤立理解,必须同时遵循这几条规律。[反馈练习]1、有X、Y两种原子,X原子的M层比Y原子的M层少3个电子,Y原子的L层电子数恰好是X原子L层电子数的二倍,则X为,Y为。2、今有结构示意图,试指出x的可能数值及相应微粒名称和符号,并画出该微粒的结构示意图。X值微粒符号微粒名称结构示意图[思考与交流]还有哪些微粒有10电子?[小结]用心爱心专心