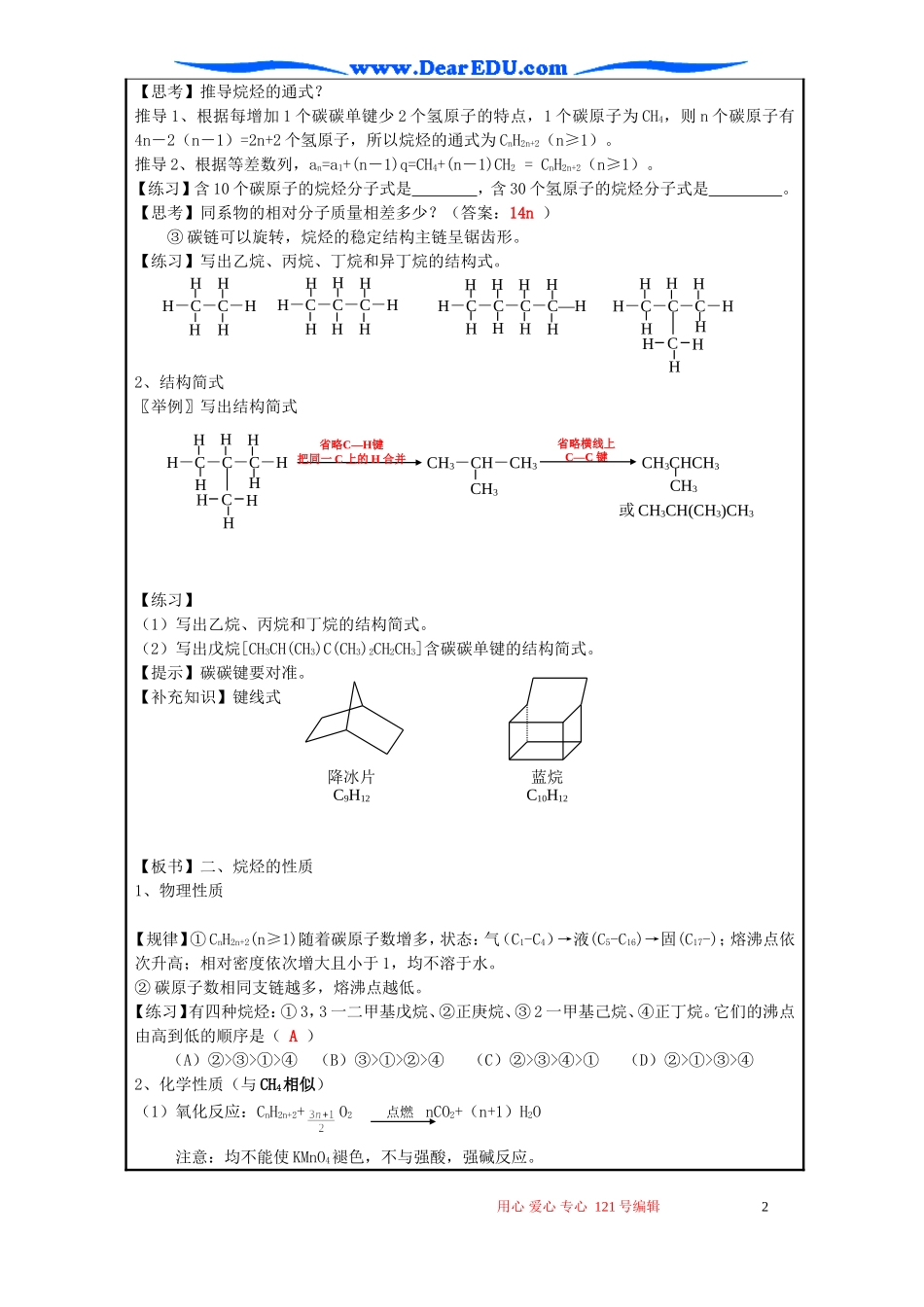
高二化学第二节烷烃教案教学课题及内容第二节烷烃(1)第教时(累计第教时)授课时间年月日目的要求1.使学生了解烷烃的组成、结构和通式;2.使学生了解烷烃性质的递变规律;3.使学生理解同系物的概念。4.通过甲烷的性质与烷烃的性质的联系,使学生理解从个别到一般的辩证唯物主义的原理。重点难点同系物、烃基等概念的理解,烷烃的性质课后小结教学说明在学习了甲烷的主要性质和结构之后,再来讨论烷烃的性质和结构就类似于在元素及其化合物知识的学习中,通过由典型到一般的学习和讨论方法,这在有机物的学习中也是一种常见且很重要的方法。对于本节的重点“烷烃的性质”在教学中注重运用了比较、分析、自学讨论等方法,以利于同学们理解和掌握。教学过程:【板书】一、烷烃1、结构【展示模型】甲烷、乙烷、丙烷、丁烷和异丁烷的球棍模型甲烷乙烷丙烷丁烷异丁烷CH4C2H6C3H8C4H10C4H10【探究】碳原子的成键特点:①碳原子间都是以碳碳单键结合成链状,碳原子剩余的价键全部跟氢原子结合。【小结】以上各结构中,每个碳原子的4个价键都充分利用,达到“饱和”。这样的烃叫做饱和链烃,又叫烷烃。②分子间相邻两个烷烃在分子组成上相差一个CH2原子团,分子间不相邻两个烷烃在分子组成上相差若干个CH2原子团。【小结】结构相似,分子组成上相差一个或若干个“CH2”原子团的物质互相称为同系物。如烷烃中的甲烷、乙烷、丙烷等,它们互为同系物。同系物特点:属于同类物质;通式相同;碳原子数不同;相对分了量相差14n用心爱心专心121号编辑1【思考】推导烷烃的通式?推导1、根据每增加1个碳碳单键少2个氢原子的特点,1个碳原子为CH4,则n个碳原子有4n―2(n―1)=2n+2个氢原子,所以烷烃的通式为CnH2n+2(n≥1)。推导2、根据等差数列,an=a1+(n―1)q=CH4+(n―1)CH2=CnH2n+2(n≥1)。【练习】含10个碳原子的烷烃分子式是,含30个氢原子的烷烃分子式是。【思考】同系物的相对分子质量相差多少?(答案:14n)③碳链可以旋转,烷烃的稳定结构主链呈锯齿形。【练习】写出乙烷、丙烷、丁烷和异丁烷的结构式。2、结构简式〖举例〗写出结构简式【练习】(1)写出乙烷、丙烷和丁烷的结构简式。(2)写出戊烷[CH3CH(CH3)C(CH3)2CH2CH3]含碳碳单键的结构简式。【提示】碳碳键要对准。【补充知识】键线式【板书】二、烷烃的性质1、物理性质【规律】①CnH2n+2(n≥1)随着碳原子数增多,状态:气(C1-C4)→液(C5-C16)→固(C17-);熔沸点依次升高;相对密度依次增大且小于1,均不溶于水。②碳原子数相同支链越多,熔沸点越低。【练习】有四种烷烃:①3,3一二甲基戊烷、②正庚烷、③2一甲基己烷、④正丁烷。它们的沸点由高到低的顺序是(A)(A)②>③>①>④(B)③>①>②>④(C)②>③>④>①(D)②>①>③>④2、化学性质(与CH4相似)(1)氧化反应:CnH2n+2+O2nCO2+(n+1)H2O注意:均不能使KMnO4褪色,不与强酸,强碱反应。用心爱心专心121号编辑2H―C―C―HHHHHH―C―C―C―HHHHHHHHH―C―C―C―C―HHHHHHHHHH―C―C―C―HHHHCHHHH省略C—H键把同一C上的H合并HH―C―C―C―HHHHCHHHH省略横线上C—C键CH3―CH―CH3CH3CH3CHCH3CH3或CH3CH(CH3)CH3降冰片C9H12蓝烷C10H12点燃(2)取代反应:在光照条件下与X2发生取代反应,产物更复杂。【思考】如何分析烷烃的n卤代物?【提示】先画出碳架,再运用对称轴法、一定一动法及等效代换法确定。【练习】分析C7H16各同分异构体一氯代物各有多少种?(对称轴法)【练习】分析C3H8二氯代物各有多少种?(4种,一定一动法)【练习】分析C3H8六氯代物各有多少种?(4种,等效代换法)(3)烷烃的受热分解由于其它烷烃的碳原子多,所以其它烷烃分解比甲烷复杂。一般甲烷高温分解、长链烷烃高温裂解、裂化。三、烃基烃失去1个氢原子后所剩余的原子团叫做烃基,用“R-”表示。烷烃失去氢原子后的原子团叫烷基,例:甲基CH3-;乙基CH3CH2-或C2H5-;丙基CH3CH2CH2-或C3H7-;异丙基CH3CHCH3思考、讨论“基”与“根”的区别,并作答。注:①、烃基不带电性。甲基②、不能客观独立存在。用心爱心专心121号编辑3HHHC····×××