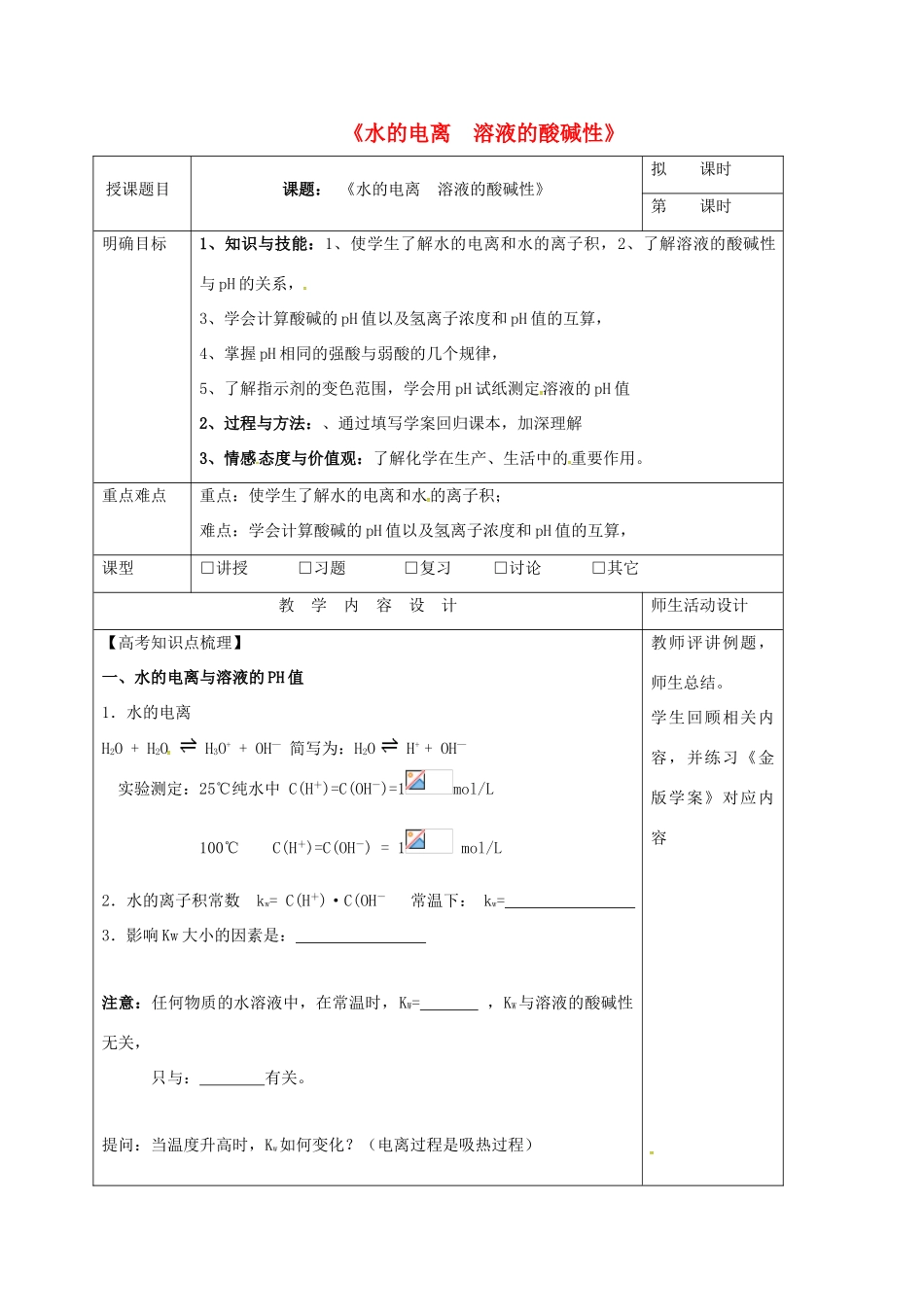
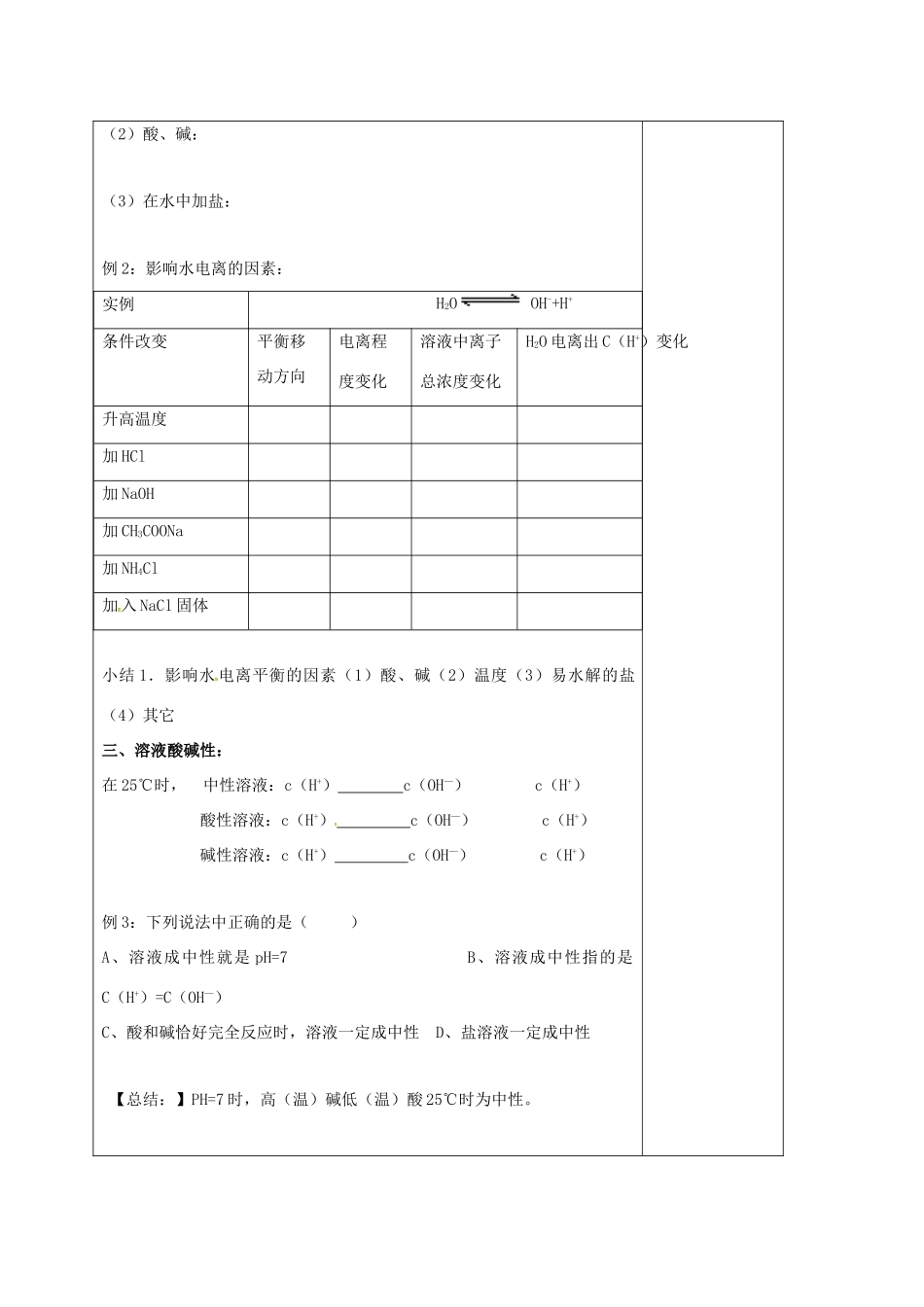
《水的电离溶液的酸碱性》授课题目[课题:《水的电离溶液的酸碱性》拟课时第课时明确目标1、知识与技能:1、使学生了解水的电离和水的离子积,2、了解溶液的酸碱性与pH的关系,3、学会计算酸碱的pH值以及氢离子浓度和pH值的互算,4、掌握pH相同的强酸与弱酸的几个规律,5、了解指示剂的变色范围,学会用pH试纸测定溶液的pH值2、过程与方法:、通过填写学案回归课本,加深理解3、情感态度与价值观:了解化学在生产、生活中的重要作用。重点难点重点:使学生了解水的电离和水的离子积;难点:学会计算酸碱的pH值以及氢离子浓度和pH值的互算,课型□讲授□习题□复习□讨论□其它教学内容设计师生活动设计【高考知识点梳理】一、水的电离与溶液的PH值1.水的电离H2O+H2OH3O++OH—简写为:H2OH++OH—实验测定:25℃纯水中C(H+)=C(OH-)=1mol/L100℃C(H+)=C(OH-)=1mol/L2.水的离子积常数kw=C(H+)·C(OH-常温下:kw=3.影响Kw大小的因素是:注意:任何物质的水溶液中,在常温时,KW=,KW与溶液的酸碱性无关,只与:有关。提问:当温度升高时,Kw如何变化?(电离过程是吸热过程)教师评讲例题,师生总结。学生回顾相关内容,并练习《金版学案》对应内容1000C时,Kw=c(H+)·c(OH—)=1×10-12影响因素:温度越高,Kw越大,水的电离程度越大。对于中性水,尽管Kw、电离度增大,但仍是中性水,[H+]=[OH-].(注:温度升高时Kw增大,所以说Kw时要强调温度。)例1:某温度下,纯水中的c(H+)=2.0×10-7mol/L,则此时溶液中c(OH-)为;若温度不变,滴入稀硫酸使c(H+)=5.0×10-6mol/L,则c(OH-)为。〖针对性训练〗1.某温度时,测得纯水中的C(H+)=2.4×10-7mol/L,则C(OH-)为()A.2.4×10-7mol/LB.0.1×10-7mol/LC.mol/LD.C(OH-)无法确定2.水的电离过程为H2OH++OH-,不同温度下其离子积常数为kw(25℃)=1.0×10-14,kw(35℃)=2.1×10-14。则下列叙述正确的是()A.C(H+)随温度升高而降低B.35℃时,C(H+)>C(OH-)C.水的电离过程是吸热的D.25℃时的水的电离程度比35℃时的大3.室温下,在PH=12的某溶液中,由水电离的C(OH-)为()A.1.0×10-7mol/LB.1.0×10-6mol/LC.1.0×10-2mol/LD.1.0×10-12mol/L二:影响水电离平衡的因素:(1)温度:(2)酸、碱:(3)在水中加盐:例2:影响水电离的因素:实例H2OOH-+H+条件改变平衡移动方向电离程度变化溶液中离子总浓度变化H2O电离出C(H+)变化升高温度加HCl加NaOH加CH3COONa加NH4Cl加入NaCl固体小结1.影响水电离平衡的因素(1)酸、碱(2)温度(3)易水解的盐(4)其它三、溶液酸碱性:在25℃时,中性溶液:c(H+)c(OH—)c(H+)酸性溶液:c(H+)c(OH—)c(H+)碱性溶液:c(H+)c(OH—)c(H+)例3:下列说法中正确的是()A、溶液成中性就是pH=7B、溶液成中性指的是C(H+)=C(OH—)C、酸和碱恰好完全反应时,溶液一定成中性D、盐溶液一定成中性【总结:】PH=7时,高(温)碱低(温)酸25℃时为中性。因材施教:教学后记: