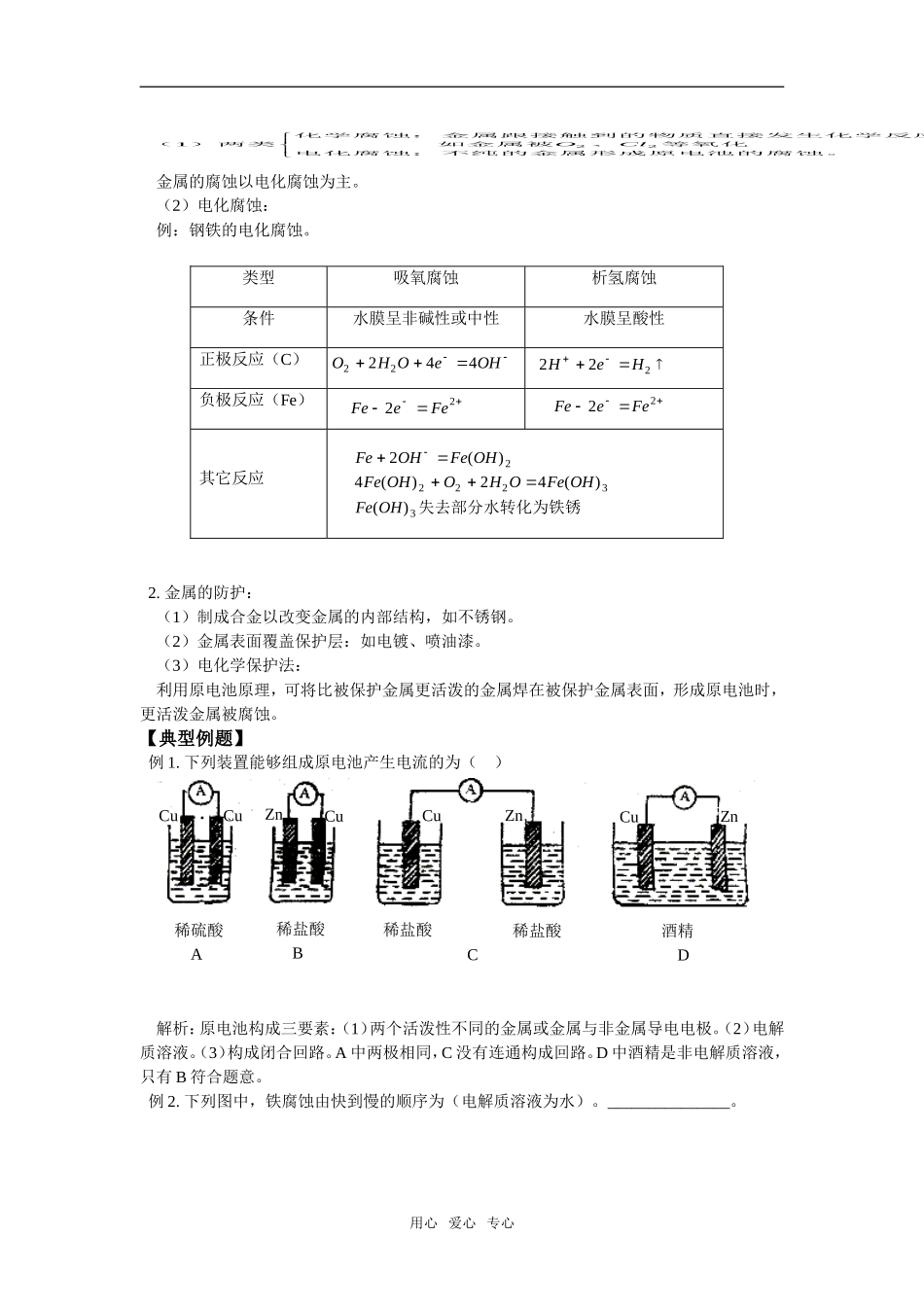
【同步知识】本周教学内容:原电池、金属的腐蚀及防护(一)原电池:1.定义:将化学能直接转化成电能的装置。2.原电池工作原理:将氧化——还原反应中的还原剂失去的电子经过导线传递给氧化剂,使氧化——还原反应分别在两个电极上进行。3.原电池的构成条件:(1)有活动性不同的两个电极,一个是较活泼的金属,另一个是较不活泼的金属、石墨(炭棒)或某些金属氧化物(如PbO2)。(2)有电解质溶液存在,必须与通过导线相连的两个电极接触。(3)构成闭合电路本质条件:负极必须被氧化,即负极必须能与电解质溶液中的某种成分反应而失电子。4.电极的名称与电极反应:(1)负极:较活泼的金属做负极,电子从负极流出,因失去电子而被氧化,发生氧化反应。正极:较不活泼的金属、石墨、金属氧化物等做正极,是电子流入的一极。一般是电解质溶液中的阳离子因得电子而发生还原反应,也有正极本身得电子的,如:PbOeHPbHO222242(2)电极反应:例如:—原电池,溶液中CuZnHSO24ZnCuZneZn较活泼作负极,其反应式为:22CuHSOHHeH做正极,溶液中得电子:24222ZnCu稀H2SO45.几种常见的电池:(1)干电池:锌为干电池的负极,碳棒为正极。以NH4Cl、ZnCl2、MnO2呈糊状液为电解质溶液。电极反应式:负极:—ZneZn22正极:222432NHeNHHMnO2吸收正极产生的H2,NH3被ZnCl2吸收。此电池反应中有可燃性气体产生,有H2O产生,用后不能扔到火中,或撞击,长时间使用后可能会漏液。用心爱心专心(2)铅蓄电池:Pb为负极,PbO2为正极,30%的H2SO4溶液为电解质溶液。负极:PbePbPbSOPbSO222424()正极:PbOHePbHOPbSOPbSO2222424422()总反应式为:PbOPbHSOPbSOHO22442222汽车用电池大多用铅蓄电池。(3)高能电池:锌银电池Zn为负极,Ag2O为正极,电解质溶液为KOH溶液(碱性电池)负极:ZneZnZnOHZnOH22222(())正极:AgOHOeAgOH22222总反应式为:ZnAgOHOAgZnOH2222()(4)碱性蓄电池:<1>铁——镍碱性蓄电池。<2>镍——镉碱性蓄电池。6.原电池原理的应用:(1)制作化学电源:可以把有些氧化——还原反应设计成原电池。FeCFeCl3溶液例如:Fe+2FeCl3=3FeCl2FeFeeFeCFeeFe负极:正极:2222232总反应式:FeFeFe2332(2)加快反应速率:例如:Zn与稀H2SO4反应:<1>用粗锌速率快:原因:Zn——稀H2SO4——杂质形成原电池。<2>稀H2SO4中加入少量CuSO4溶液,速率加快原因:Zn——稀H2SO4——Cu原电池(二)金属的腐蚀与防护:1.金属的腐蚀:用心爱心专心()两类化学腐蚀:金属跟接触到的物质直接发生化学反应而引起的如金属被、等氧化电化腐蚀:不纯的金属形成原电池的腐蚀。122OCl金属的腐蚀以电化腐蚀为主。(2)电化腐蚀:例:钢铁的电化腐蚀。类型吸氧腐蚀析氢腐蚀条件水膜呈非碱性或中性水膜呈酸性正极反应(C)负极反应(Fe)其它反应OHOeOH22244222HeHFeeFe22FeeFe22FeOHFeOHFeOHOHOFeOHFeOH2424222233()()()()失去部分水转化为铁锈2.金属的防护:(1)制成合金以改变金属的内部结构,如不锈钢。(2)金属表面覆盖保护层:如电镀、喷油漆。(3)电化学保护法:利用原电池原理,可将比被保护金属更活泼的金属焊在被保护金属表面,形成原电池时,更活泼金属被腐蚀。【典型例题】例1.下列装置能够组成原电池产生电流的为()CuCuCuCuCuZnZnZn稀硫酸A稀盐酸B稀盐酸稀盐酸C酒精D解析:原电池构成三要素:(1)两个活泼性不同的金属或金属与非金属导电电极。(2)电解质溶液。(3)构成闭合回路。A中两极相同,C没有连通构成回路。D中酒精是非电解质溶液,只有B符合题意。例2.下列图中,铁腐蚀由快到慢的顺序为(电解质溶液为水)。_______________。用心爱心专心FeFeFeFeFeFeCuCuCu(1)(2)(3)(4)(5)(6)油锌解析:(1)中Fe与水在空气存在时,O2溶解在水中,可能构成电池,(2)中,如果在水上加一层油,则无O2,难以构成吸氧腐蚀,(3)中Zn和Fe连在一起,Zn较Fe活泼,Zn失去电子,铁被...