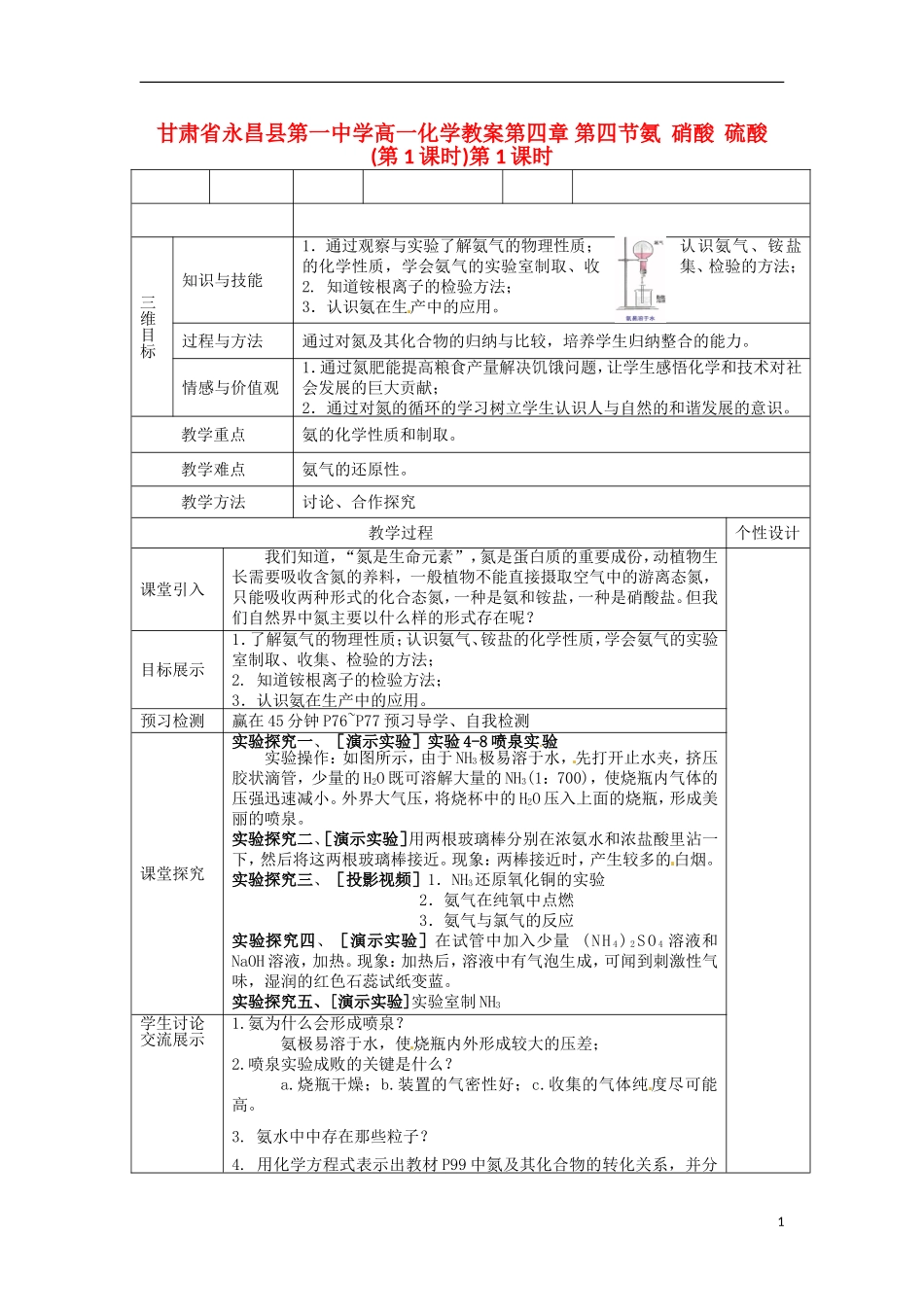
甘肃省永昌县第一中学高一化学教案第四章第四节氨硝酸硫酸(第1课时)第1课时三维目[标知识与技能1.通过观察与实验了解氨气的物理性质;认识氨气、铵盐的化学性质,学会氨气的实验室制取、收集、检验的方法;2.知道铵根离子的检验方法;3.认识氨在生产中的应用。过程与方法通过对氮及其化合物的归纳与比较,培养学生归纳整合的能力。情感与价值观1.通过氮肥能提高粮食产量解决饥饿问题,让学生感悟化学和技术对社会发展的巨大贡献;2.通过对氮的循环的学习树立学生认识人与自然的和谐发展的意识。教学重点氨的化学性质和制取。教学难点氨气的还原性。教学方法讨论、合作探究教学过程个性设计课堂引入我们知道,“氮是生命元素”,氮是蛋白质的重要成份,动植物生长需要吸收含氮的养料,一般植物不能直接摄取空气中的游离态氮,只能吸收两种形式的化合态氮,一种是氨和铵盐,一种是硝酸盐。但我们自然界中氮主要以什么样的形式存在呢?目标展示1.了解氨气的物理性质;认识氨气、铵盐的化学性质,学会氨气的实验室制取、收集、检验的方法;2.知道铵根离子的检验方法;3.认识氨在生产中的应用。预习检测赢在45分钟P76~P77预习导学、自我检测课堂探究实验探究一、[演示实验]实验4-8喷泉实验实验操作:如图所示,由于NH3极易溶于水,先打开止水夹,挤压胶状滴管,少量的H2O既可溶解大量的NH3(1:700),使烧瓶内气体的压强迅速减小。外界大气压,将烧杯中的H2O压入上面的烧瓶,形成美丽的喷泉。实验探究二、[演示实验]用两根玻璃棒分别在浓氨水和浓盐酸里沾一下,然后将这两根玻璃棒接近。现象:两棒接近时,产生较多的白烟。实验探究三、[投影视频]1.NH3还原氧化铜的实验2.氨气在纯氧中点燃3.氨气与氯气的反应实验探究四、[演示实验]在试管中加入少量(NH4)2SO4溶液和NaOH溶液,加热。现象:加热后,溶液中有气泡生成,可闻到刺激性气味,湿润的红色石蕊试纸变蓝。实验探究五、[演示实验]实验室制NH3学生讨论交流展示1.氨为什么会形成喷泉?氨极易溶于水,使烧瓶内外形成较大的压差;2.喷泉实验成败的关键是什么?a.烧瓶干燥;b.装置的气密性好;c.收集的气体纯度尽可能高。3.氨水中中存在那些粒子?4.用化学方程式表示出教材P99中氮及其化合物的转化关系,并分1析反应中元素化合价的变化,指出氧化剂和还原剂。5.实验室如何检验铵根离子?6.实验室如何干燥和收集氨气?疑难点拨氨气的还原性(1)NH3还原氧化铜:2NH3+3CuO△3Cu+N2+3H2O(2)与纯氧的反应:4NH3+3O2(纯)点燃2N2+6H2O(3)与氯气的反应:若NH3不足,则2NH3+3Cl2==6HCl+N2若NH3充足,则8NH3+3Cl2==6NH4Cl+N2课堂小结第四章第一节氨硫酸硝酸一、氨(一)氨的物理性质无色,有特殊刺激性气味的气体,密度比空气小。极易液化,液氨汽化时要吸收大量热,极易溶于水,氨水密度比水小。(二)氨的化学性质1.与H2O反应NH3+H2ONH3·H2ONH4++OH―NH3·H2O△NH3↑+H2O2.与酸反应NH3+HCl==NH4Cl(产生白烟,可用于检验NH3)2NH3+H2SO4==(NH4)2SO4(吸收NH3的方法)3.氨的催化氧化:4NH3+5O2催化剂△4NO+6H2O4.氨气的还原性(1)NH3还原氧化铜:2NH3+3CuO△3Cu+N2+3H2O(2)与纯氧的反应:4NH3+3O2(纯)点燃2N2+6H2O(3)与氯气的反应:若NH3不足,则2NH3+3Cl2==6HCl+N2若NH3充足,则8NH3+3Cl2==6NH4Cl+N2(三)铵盐1.物理性质:易溶于水无色晶体。2.化学性质(1)铵盐受热易分解NH4HCO3==NH3↑+H2O+CO2↑NH4Cl△NH3↑+HCl↑2NH4NO3===2N2↑+O2↑+4H2O(加热到500℃)(2)与碱反应(NH4)2SO4+2NaOH△Na2SO4+2NH3↑+2H2O(3)NH4+的检验原理:NH4++OH―△NH3↑+H2O现象:有刺激性气味气体产生,能使红色石蕊试纸变蓝。(四)实验室制NH31.实验原理:2NH4Cl+Ca(OH)2△CaCl2+2NH3↑+2H2O2.干燥剂:碱石灰3.收集方法:向下排空气法4.检验:(1)湿润的红色石蕊试纸――变蓝(2)沾有浓盐酸的玻璃棒接近瓶口------白烟25.棉花团的作用:防止试管内的NH3与管外空气形成对流达标检测赢在45分钟随堂训练作业设计预习P100-P102课文,完成赢在45分钟P79自主预习和自我检测课后反思3