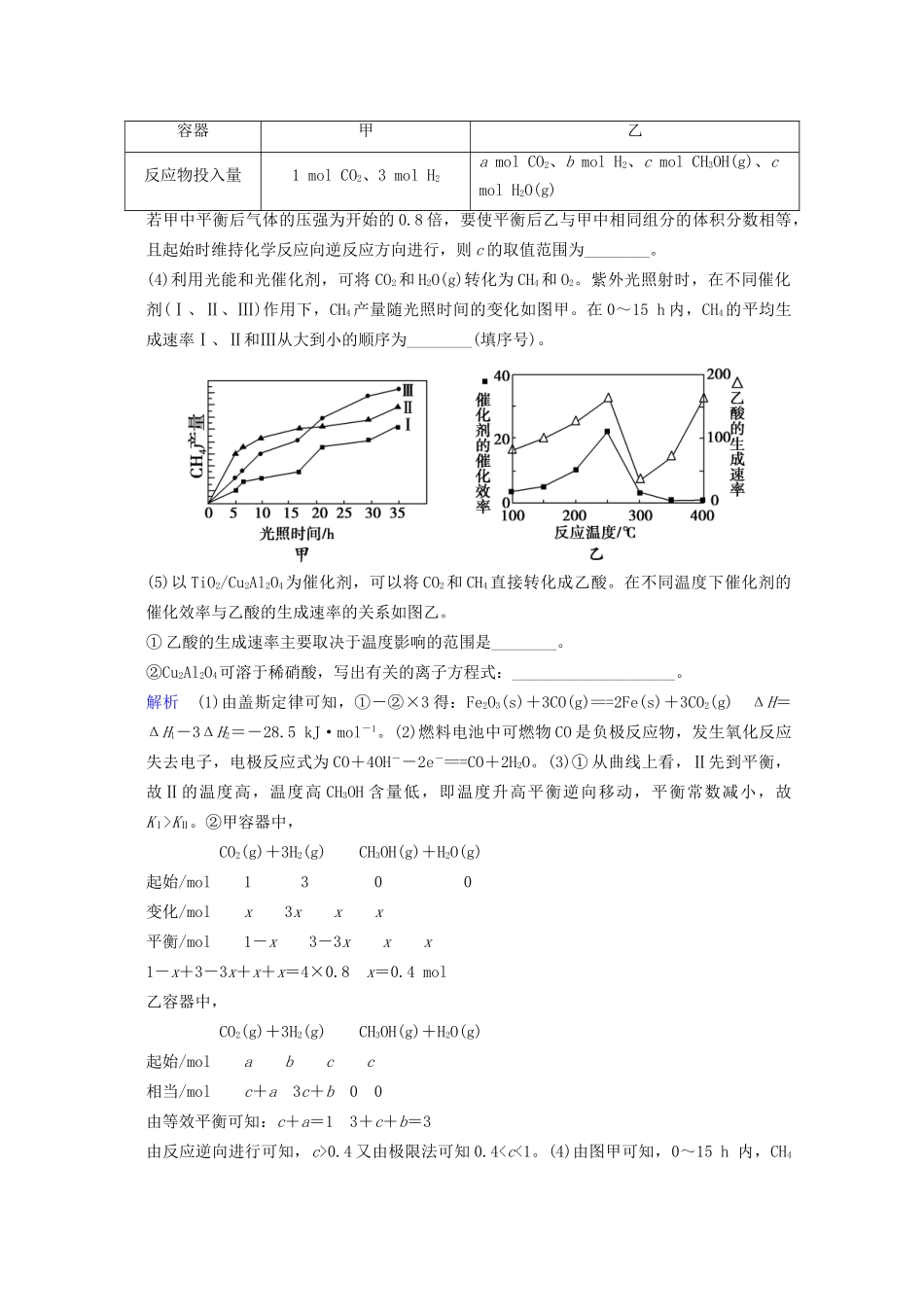
【创新设计】(江苏专用)高考化学二轮题型专攻微题型18化学反应原理综合题(含新题,含解析)[题型专练]1.硫、硫化物和硫酸盐在自然界中都存在。(1)硫酸是基础化学工业的重要产品,下列为接触法制硫酸的反应:4FeS2(s)+11O2(g)====2Fe2O3(s)+8SO2(g)ΔH=-3412kJ·mol-12SO2(g)+O2(g)2SO3(g)ΔH=-196.6kJ·mol-1SO3(g)+H2O(l)===H2SO4(l)ΔH=-130.3kJ·mol-1理论上,用FeS2为原料生产2molH2SO4(l)所释放的热量为______________kJ·mol-1。(2)硫酸生产过程中会产生硫酸渣,其成分主要为Fe(约55%)、CaO和CaS(约16%)、SiO2(约11%)、MgO(约6%)、Al2O3(约10%)。一种利用硫酸渣制备绿矾(FeSO4·7H2O)的工艺流程如下:几种离子沉淀的pH开始沉淀的pH沉淀完全的pHAl3+3.24.4Fe2+6.38.4Ca2+11.8\Mg2+8.810.8回答下列问题:①上述流程中加入铁屑时反应的离子方程式为__________________________。②上述制备过程中加入CaO调节pH=4.5时,产生沉淀的主要成分为_______。③精制FeSO4·7H2O前,需向滤液中加入H2SO4调节pH,其目的是_________________________________________。④研究发现,其他条件相同,结晶温度在70℃左右时硫酸亚铁纯度最高。分析温度大于70℃时,硫酸亚铁纯度降低的主要原因可能为_____________________________________________。(3)H2S是一种无色、有毒且有恶臭味的气体。煤的低温焦化,含硫石油开采、提炼,橡胶、制革、染料、制糖等工业中都有H2S—产生。某研究小组设计了一种硫化氢空气燃料电池,总反应为2H2S+O2===2S+2H2O,简易结构如图所示。①硫化氢应通入到电极________(“填a”“或b”)②b极发生的电极反应式为_____________________________________。解析(1)根据盖斯定律可得,以FeS2为原料生产H2SO4(l)总的热化学方程式是2FeS2(s)+O2(g)+4H2O(l)===Fe2O3(s)+4H2SO4(l)ΔH=-2620.4kJ·mol-1,生产2molH2SO4(l)所释放的热量为1310.2kJ·mol-1。(2)①硫酸渣酸溶后的溶液中含Ca2+、Fe2+、Fe3+、Al3+、Mg2+、H+,加入铁屑,与Fe3+、H+反应。②pH=4.5时Al3+生成沉淀,同时也有CaSO4沉淀生成。(3)由电子流动方向可知b电极为负极,再根据总方程式,H2S是还原剂,是负极反应物,发生氧化反应。答案(1)1310.2(2)①Fe+2H+===Fe2++H2↑,Fe+2Fe3+===3Fe2+②CaSO4、Al(OH)3③抑制Fe2+水解④Fe2+被氧化成Fe3+的量增多(3)①b②H2S+O2--2e-===S+H2O2.研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。(1)CO可用于炼铁,已知:①Fe2O3(s)+3C(s)===2Fe(s)+3CO(g)ΔH1=+489.0kJ·mol-1,②C(s)+CO2(g)===2CO(g)ΔH2=+172.5kJ·mol-1。则CO还原Fe2O3(s)的热化学方程式为______________________________。(2)分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液)。写出该电池的负极反应式:__________。(3)CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g)。测得CH3OH的物质的量随时间的变化如图所示。①曲线Ⅰ、Ⅱ对应的平衡常数大小关系为KI________KⅡ。(“填>”“”“、=或<”)②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。容器甲乙反应物投入量1molCO2、3molH2amolCO2、bmolH2、cmolCH3OH(g)、cmolH2O(g)若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为________。(4)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,CH4产量随光照时间的变化如图甲。在0~15h内,CH4的平均生成速率Ⅰ、Ⅱ和Ⅲ从大到小的顺序为________(填序号)。(5)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系如图乙。①乙酸的生成速率主要取决于温度影响的范围是________。②Cu2Al2O4可溶于稀硝酸,写出有关的离子方程式:____________________。解析(1)由盖斯定律可知,①-②×3得:Fe2O3...