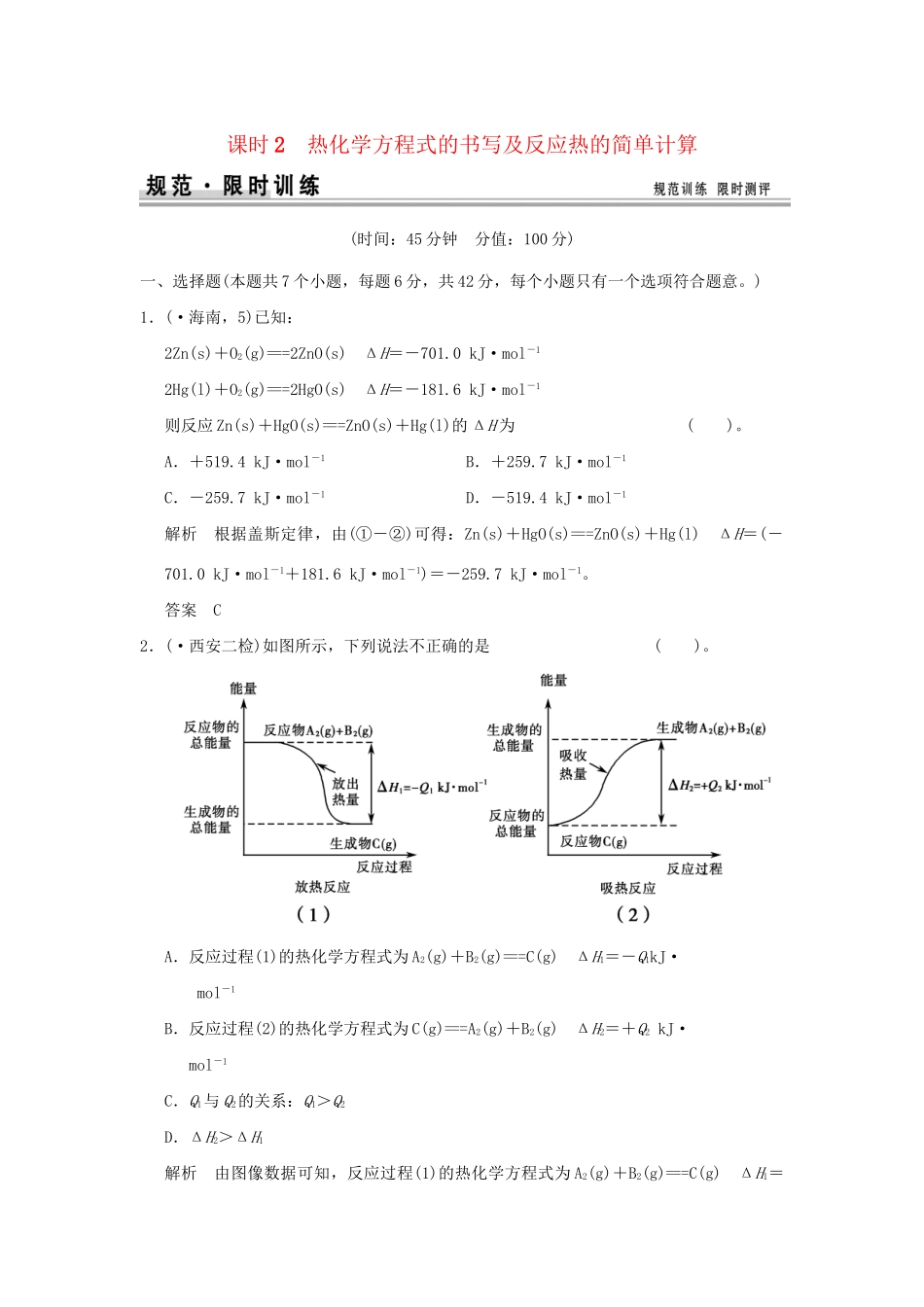
课时2热化学方程式的书写及反应热的简单计算(时间:45分钟分值:100分)一、选择题(本题共7个小题,每题6分,共42分,每个小题只有一个选项符合题意。)1.(·海南,5)已知:2Zn(s)+O2(g)===2ZnO(s)ΔH=-701.0kJ·mol-12Hg(l)+O2(g)===2HgO(s)ΔH=-181.6kJ·mol-1则反应Zn(s)+HgO(s)===ZnO(s)+Hg(l)的ΔH为()。A.+519.4kJ·mol-1B.+259.7kJ·mol-1C.-259.7kJ·mol-1D.-519.4kJ·mol-1解析根据盖斯定律,由(①-②)可得:Zn(s)+HgO(s)===ZnO(s)+Hg(l)ΔH=(-701.0kJ·mol-1+181.6kJ·mol-1)=-259.7kJ·mol-1。答案C2.(·西安二检)如图所示,下列说法不正确的是()。A.反应过程(1)的热化学方程式为A2(g)+B2(g)===C(g)ΔH1=-Q1kJ·mol-1B.反应过程(2)的热化学方程式为C(g)===A2(g)+B2(g)ΔH2=+Q2kJ·mol-1C.Q1与Q2的关系:Q1>Q2D.ΔH2>ΔH1解析由图像数据可知,反应过程(1)的热化学方程式为A2(g)+B2(g)===C(g)ΔH1=-Q1kJ·mol-1。反应过程(2)的热化学方程式为C(g)===A2(g)+B2(g)ΔH2=+Q2kJ·mol-1,反应过程(1)与反应过程(2)中,反应物、生成物所涉及物质及状态均相同,只是过程相反,故反应热的数值相等,符号相反。注意比较ΔH的大小时,要注意考虑其正负号。答案C3.(·福州期末)化学反应的本质是旧化学健的断裂和新化学键的形成。已知某些化学键的键能数据如下:化学键H—HCl—ClH—Cl键能/(kJ·mol-1)436243431则下列热化学方程式不正确的是()。A.H2(g)+Cl2(g)===HCl(g)ΔH=-91.5kJ·mol-1B.H2(g)+Cl2(g)===2HCl(g)ΔH=-183kJ·mol-1C.H2(g)+Cl2(g)===HCl(g)ΔH=+91.5kJ·mol-1D.2HCl(g)===H2(g)+Cl2(g)ΔH=+183kJ·mol-1解析化学反应的焓变ΔH=反应物的键能之和-生成物的键能之和,反应H2(g)+Cl2(g)===HCl(g)的ΔH=(436kJ·mol-1+243kJ·mol-1)/2-431kJ·mol-1=-91.5kJ·mol-1,所以A项正确,C项错误;B项反应的ΔH=-91.5kJ·mol-1×2=-183kJ·mol-1,正确;D项反应是B项反应的逆反应,生成HCl的反应是放热反应,则HCl的分解反应是吸热反应,吸收的热量与放出的热量相等,D项正确。答案C4.下列各组热化学方程式中,化学反应的ΔH前者大于后者的是()。①C(s)+O2(g)===CO2(g)ΔH1C(s)+O2(g)===CO(g)ΔH2②S(s)+O2(g)===SO2(g)ΔH3S(g)+O2(g)===SO2(g)ΔH4③H2(g)+O2(g)===H2O(l)ΔH52H2(g)+O2(g)===2H2O(l)ΔH6④CaCO3(s)===CaO(s)+CO2(g)ΔH7CaO(s)+H2O(l)===Ca(OH)2(s)ΔH8A.①B.①④C.②③④D.①②③解析①碳与氧气反应放热,即ΔH1<0,ΔH2<0,CO再与O2作用时又放热,前者放出热量多,所以ΔH1<ΔH2;②等量的固态硫变为硫蒸气时吸收热量,故在与O2作用产生同样多的SO2时,气态硫放出的热量多,即ΔH3>ΔH4;③发生同样的燃烧反应,物质的量越多,放出的热量越多,故ΔH5>ΔH6;④碳酸钙分解吸收热量,ΔH7>0,CaO与H2O反应放出热量,ΔH8<0,显然ΔH7>ΔH8。答案C5.(·徐州模拟)已知①C2H5OH(g)+3O2(g)===2CO2(g)+3H2O(g)ΔH1=-Q1kJ·mol-1;②C2H5OH(g)===C2H5OH(l)ΔH2=-Q2kJ·mol-1;③H2O(g)===H2O(l)ΔH3=-Q3kJ·mol-1;若使23g液体酒精完全燃烧,恢复到室温,则放出的热量(kJ)为()。A.Q1+Q2+Q3B.0.5Q1-0.5Q2+1.5Q3C.0.5(Q1+Q2+Q3)D.0.5Q1-1.5Q2+0.5Q3解析根据盖斯定律,由①-②+③×3,得C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l)ΔH=-(Q1-Q2+3Q3)kJ·mol-1,所以23g液体酒精完全燃烧,恢复到室温,放出的热量为(0.5Q1-0.5Q2+1.5Q3)kJ。答案B6.如图所示是101kPa时氢气在氯气中燃烧生成氯化氢气体的能量变化,则下列有关说法中不正确的是()。A.1molH2中的化学键断裂时需要吸收436kJ能量B.2molHCl分子中的化学键形成时要释放862kJ能量C.此反应的热化学方程式为:H2(g)+Cl2(g)===2HCl(g)ΔH=+183kJ·mol-1D.此反应的热化学方程式为:H2(g)+Cl2(g)===HCl(g)ΔH=-91.5kJ·mol-1解析题图表示1molH—H键断裂时需要吸收436kJ能量,1molCl—Cl键断裂时需要吸收243kJ能量,1molH—Cl键形成时放出431kJ能量,由此可知A、B正确...