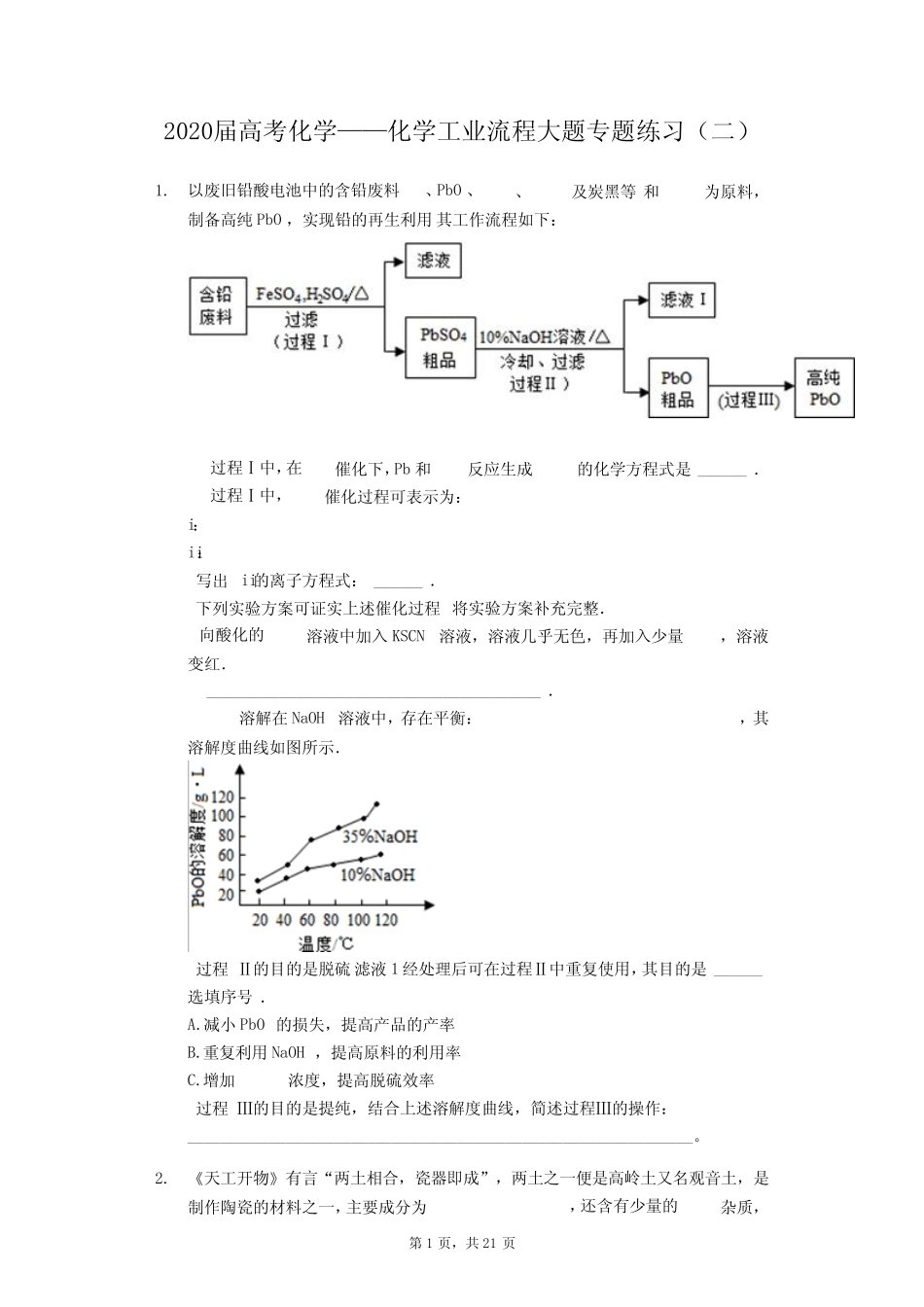
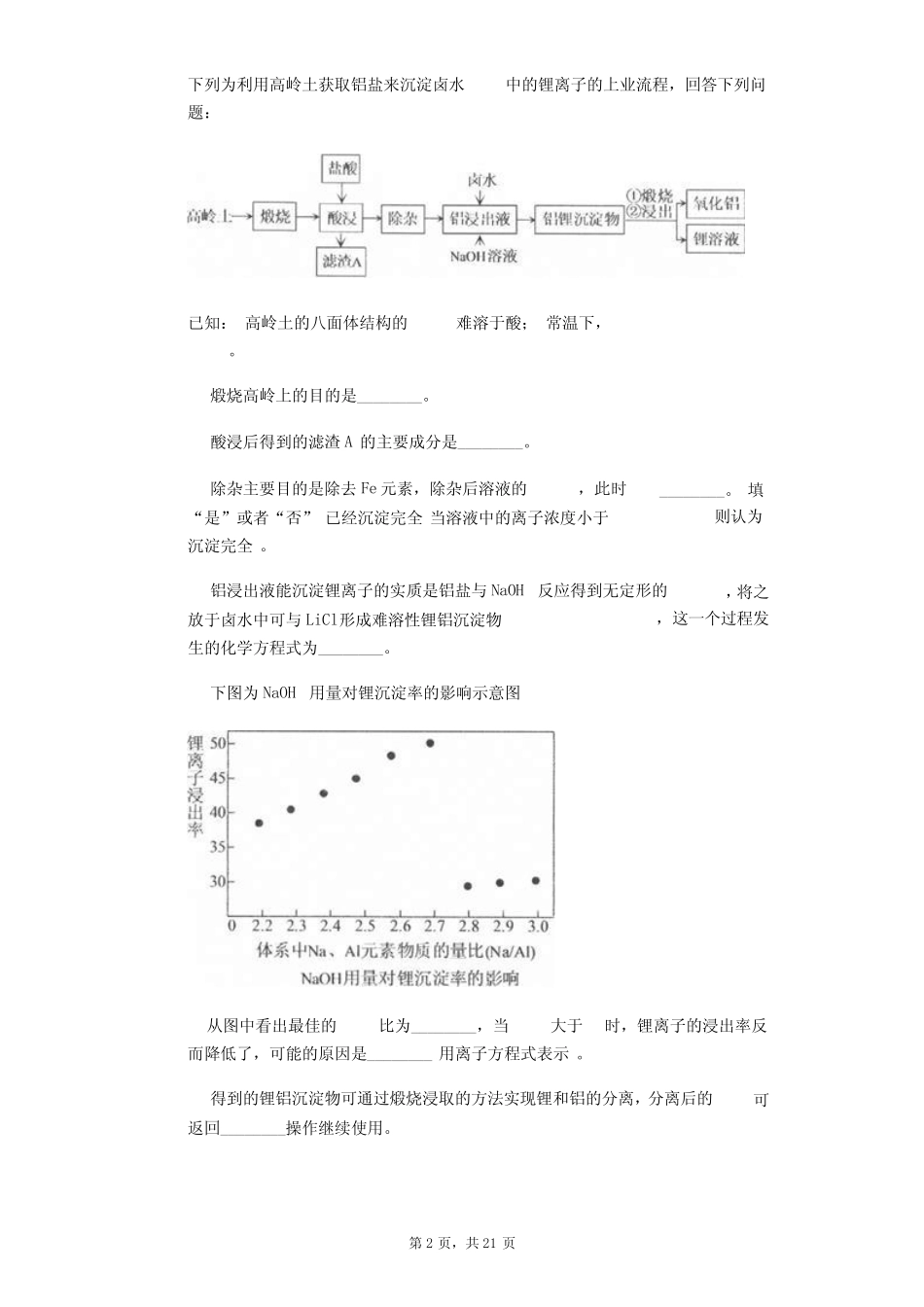
第1页,共21页2020届高考化学——化学工业流程大题专题练习(二)1.以废旧铅酸电池中的含铅废料、PbO、、及炭黑等和为原料,制备高纯PbO,实现铅的再生利用其工作流程如下:过程Ⅰ中,在催化下,Pb和反应生成的化学方程式是______.过程Ⅰ中,催化过程可表示为:i:ii:写出ii的离子方程式:______.下列实验方案可证实上述催化过程将实验方案补充完整.向酸化的溶液中加入KSCN溶液,溶液几乎无色,再加入少量,溶液变红._________________________________________.溶解在NaOH溶液中,存在平衡:,其溶解度曲线如图所示.过程Ⅱ的目的是脱硫滤液1经处理后可在过程Ⅱ中重复使用,其目的是______选填序号.A.减小PbO的损失,提高产品的产率B.重复利用NaOH,提高原料的利用率C.增加浓度,提高脱硫效率过程Ⅲ的目的是提纯,结合上述溶解度曲线,简述过程Ⅲ的操作:______________________________________________________________。2.《天工开物》有言“两土相合,瓷器即成”,两土之一便是高岭土又名观音土,是制作陶瓷的材料之一,主要成分为,还含有少量的杂质,第2页,共21页下列为利用高岭土获取铝盐来沉淀卤水中的锂离子的上业流程,回答下列问题:已知:高岭土的八面体结构的难溶于酸;常温下,。煅烧高岭上的目的是________。酸浸后得到的滤渣A的主要成分是________。除杂主要目的是除去Fe元素,除杂后溶液的,此时________。填“是”或者“否”已经沉淀完全当溶液中的离子浓度小于则认为沉淀完全。铝浸出液能沉淀锂离子的实质是铝盐与NaOH反应得到无定形的,将之放于卤水中可与LiCl形成难溶性锂铝沉淀物,这一个过程发生的化学方程式为________。下图为NaOH用量对锂沉淀率的影响示意图从图中看出最佳的比为________,当大于时,锂离子的浸出率反而降低了,可能的原因是________用离子方程式表示。得到的锂铝沉淀物可通过煅烧浸取的方法实现锂和铝的分离,分离后的可返回________操作继续使用。第3页,共21页3.锑被广泛用于生产各种阻燃剂、合金、陶瓷、半导体元件、医药用品等。以辉锑矿为原料制备金属锑的一种工艺流程如下:已知部分信息如下:Ⅰ辉锑矿的主要成分为,还含有、PbS、CuO和等;Ⅱ浸出液主要含盐酸和,还含、、和等杂质;Ⅲ常温下,,。回答下列问题:“酸浸”过程中和反应有S生成,该反应的还原产物是________________填化学式。写出“还原”反应的化学方程式:_______________________________________________。已知:浸出液中、。在沉淀铜、铅过程中,缓慢滴加极稀的硫化钠溶液,先产生的沉淀是________________________填化学式;当CuS、PbS共沉时,________。加入硫化钠的量不宜过多,原因是____________________________。在“除砷”过程中,氧化产物为。该反应中氧化剂、还原剂的物质的量之比为________。4.铁及其化合物在日常生活中占据着非常重要的地位。某工厂利用硫酸渣主要成分为:约,约,约,MgO约废渣制取药用辅料——红氧化铁的工艺流程如下部分操作和条件略,请回答:步骤i焙烧产生的有毒气体可能有和_____。步骤所得滤渣中可能有、SiC、_____填化学式以及煤炭中的不溶性杂质等。第4页,共21页步骤iii在室温下进行,分为两步:加氨水调pH至____以上已知,使完全沉淀离子浓度小于,过滤得到滤液。加某种有机萃取剂萃取出______填离子符号,分液,分离出水层溶液。步骤iv生成的离子反应为__________________________________________。为验证所得的红氧化铁产品中是否含有FeO杂质,取少量固体于试管中,加过量稀硫酸溶解,再加入_________溶液填化学式,观察到有______色沉淀产生,证明产品中有FeO杂质。为进一步确定其比例,设计了如下实验:称量样品于烧杯中,用过量稀溶解并配制为溶液。取该溶液于锥形瓶中,加入几滴二苯胺磺酸钠溶液作指示剂无色,被氧化后变为紫色,用溶液滴定至终点,消耗体积为。滴定终点的颜色变化是_________________________________,该产品中FeO杂质的质量分数为________________。5.双氧水在医疗、军事和工业上用途广泛,目前成熟的合成工艺为乙基蒽醌法。已知:反应原理为EAHQ,。工业制备流程如下所示。制备...